kategorije: Izdvojeni članci » Početnici električari
Broj pregledavanja: 36288
Komentari na članak: 1
Kemijski izvori struje: glavne karakteristike
 Čovječanstvo već više od dva stoljeća koristi energiju kemijskih reakcija između različitih tvari za proizvodnju istosmjerne struje.
Čovječanstvo već više od dva stoljeća koristi energiju kemijskih reakcija između različitih tvari za proizvodnju istosmjerne struje.
Princip rada
Redoks reakcija koja nastaje između tvari sa svojstvima oksidirajućeg i reducirajućeg agensa prati oslobađanje elektrona, čije gibanje tvori električnu struju. Međutim, da bi se iskoristila njegova energija, potrebno je stvoriti uvjete za prolazak elektrona kroz vanjski krug, jer se u protivnom toplinom oslobađa jednostavne mješavine oksidacijskog i reducirajućeg sredstva.
Stoga svi kemijski izvori struje imaju dvije elektrode:
-
anoda na kojoj dolazi do oksidacije;
-
katoda, provodeći obnavljanje tvari.
Elektrode na daljinu postavljaju se u posudu s elektrolitom - tvar koja provodi električnu struju zbog procesa disocijacije medija u ione.
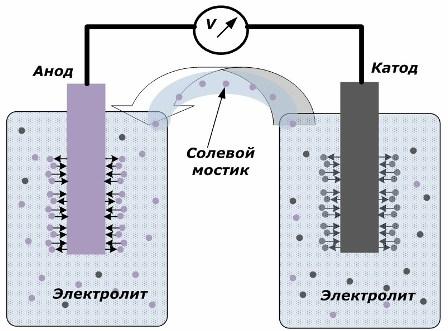
Princip pretvaranja kemijske energije u električnu
Na slici se vidi da su elektrode smještene u zasebne posude povezane slanim mostom kroz koji se stvara kretanje iona duž unutarnjeg kruga. Kad su vanjski i unutarnji krugovi otvoreni, na elektrodama se događaju dva procesa: prijelaz iona iz metala elektrode u elektrolit i prijelaz iona iz elektrolita u kristalnu rešetku elektroda.
Brzina protoka ovih procesa je jednaka i naponski potencijali suprotnih znakova akumuliraju se na svakoj elektrodi. Ako su povezani preko solnog mosta i postavilo se opterećenje, pojavit će se električni krug. Kretanje iona između elektroda kroz elektrolit i solni most nastaje unutarnja struja. Dolazi do kretanja elektrona duž vanjskog kruga od anode do katode.
Gotovo sve redoks reakcije popraćene su proizvodnjom električne energije. Ali njegova vrijednost ovisi o mnogim čimbenicima, uključujući količinu i masu kemikalija koje se koriste, materijale za izradu elektroda, poput elektrolita, koncentracije iona, dizajna.
U modernim kemijskim izvorima struje najčešće se koriste:
-
za materijal anode (redukcijsko sredstvo), cink (Zn), olovo (Pb), kadmij (Cd) i neke druge metale;
-
za katodni materijal (oksidant) - olovni oksid PbO2, manganov oksid MnO2, nikl hidroksid NiOOH i drugi;
-
elektroliti na bazi otopina kiselina, alkalija ili soli.
Metode klasifikacije
Jedan dio kemijskih izvora energije može se ponovno upotrijebiti, dok drugi ne može. Ovaj je princip uzet kao osnova za njihovo razvrstavanje.
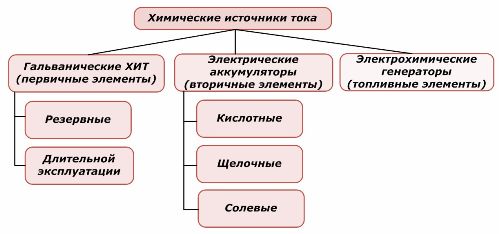
Razvrstavanje kemijskih elemenata
Elektromotorna sila galvanske stanice, ovisno o dizajnu, dostiže 1,2 ÷ 1,5 volti. Da bi se postigle velike vrijednosti, kombiniraju se u baterije, spajajući se serijski. Kad su baterije paralelno povezane, struja i snaga se povećavaju.
Opće je prihvaćeno da primarni kemijski izvori struje ne podržavaju ponovno punjenje, mada se preciznije ovaj položaj može formulirati drugačije: njegova primjena nije ekonomski izvediva.
Suvišni primarni kemijski izvori struje pohranjuju se u stanju u kojem je elektrolit izoliran od elektroda. Time se eliminira pojava redoks reakcije i osigurava spremnost za pokretanje. Ne koriste se ponovno. Rok trajanja rezervnih izvora energije je ograničen na 10–15 godina.
Baterije se uspješno pune primjenom vanjske električne energije. Zbog ove osobine nazivaju se sekundarni izvori struje. Oni su u stanju izdržati stotine i tisuće ciklusa punjenja i punjenja.EMF baterije može biti u rasponu od 1,0 ÷ 1,5 volta. Kombiniraju se i u baterije.
Elektrokemijski generatori djeluju na principu galvanskih ćelija, ali za provođenje elektrokemijske reakcije tvari dolaze izvana, a svi oslobođeni proizvodi uklanjaju se iz elektrolita. To vam omogućuje da organizirate kontinuirani proces.
Ključne karakteristike radnih svojstava kemijskih izvora energije
1. Napon preko otvorenih terminala
Ovisno o dizajnu, jedan izvor može stvoriti samo određenu potencijalnu razliku. Za uporabu u električnim uređajima kombiniraju se u baterije.
2. Specifični kapacitet
Za određeno vrijeme (u satima) jedan izvor kemijske struje može stvoriti ograničenu količinu struje (u amperima), koja se pripisuje jedinici težine ili zapremine.
3. Gustoća snage
Karakterizira sposobnost jedinice mase ili volumena kemijskog izvora struje da generira snagu generiranu proizvodom napona pomoću trenutne snage.
4. Trajanje rada
Ovaj se parametar naziva i datum isteka.
5. Vrijednost struje samoispražnjenja
Ti sporedni procesi elektrokemijskih reakcija dovode do potrošnje aktivne mase elemenata, uzrokuju koroziju i smanjuju specifični kapacitet.
6. Cijena proizvoda
Ovisi o dizajnu, korištenim materijalima i nizu drugih faktora.
Najbolji izvori kemijske struje su oni sa visokim vrijednostima prva četiri parametra, a samopražnjenje i trošak su niski.
Načela punjenja baterije
Među sekundarnim kemijskim izvorima struje dobivaju veliku popularnost. litij-ionski modeli, koji su postali široko korišteni za napajanje elektroničkih uređaja. Koriste LiMO2 (M Co, Ni, Mn) kao materijal pozitivne elektrode, a grafit kao negativ.
Kad se napune, litijevi ioni iz primijenjene vanjske energije oslobađaju se iz katodnog metala, prolaze kroz elektrolit i prodiru u prostor između slojeva grafita, nakupljajući se tamo.
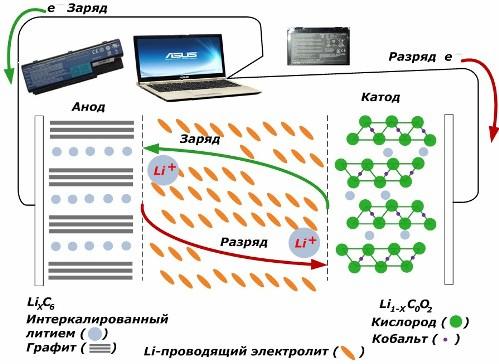
Kad energija punjač je odsutan, a opterećenje je povezano s elektrodama, a zatim se litijevi ioni u elektrolitu kreću u suprotnom smjeru.
Ako se punjenje i pražnjenje ne vrši, tada se energija u bateriji ne troši, nego se pohranjuje. Ali njegova količina ograničena je svojstvima upotrijebljenih materijala. Primjerice, u litij-ionskim baterijama specifični električni kapacitet je 130 ÷ 150 mAh / g. Ograničena je svojstvima materijala anode. Za grafit je kapacitet oko dva puta veći.
Znanstvenici sada traže načine povećanja kapaciteta baterije, istražuju mogućnost upotrebe kemijske reakcije između litija i kisika u zraku. Da biste to učinili, dizajnirani su s zračnom, ne trošnom katodom, koja se koristi u zasebnim baterijama. Ovom metodom možete povećati gustoću energije do 10 puta.
Za rad kemijskih izvora struje potrebno je znanje osnove elektrotehnike, elektrokemija, znanost o materijalima i fizika čvrstog stanja.
Pogledajte također na elektrohomepro.com
:
