kategorije: Izdvojeni članci » Početnici električari
Broj pregledavanja: 70526
Komentari na članak: 0
Galvanske ćelije - uređaj, princip rada, vrste i glavne karakteristike
Preduvjeti za pojavu galvanskih stanica. Malo povijesti. 1786. talijanski profesor medicine, fiziolog Luigi Aloisio Galvani otkrio je zanimljiv fenomen: mišići zadnjih nogu svježe otvorenog leša žabe obješene na bakrenim kukama ugovarali su se kad ih je znanstvenik dodirnuo čeličnim skalpelom. Galvani je odmah zaključio da je to manifestacija "životinjske struje".
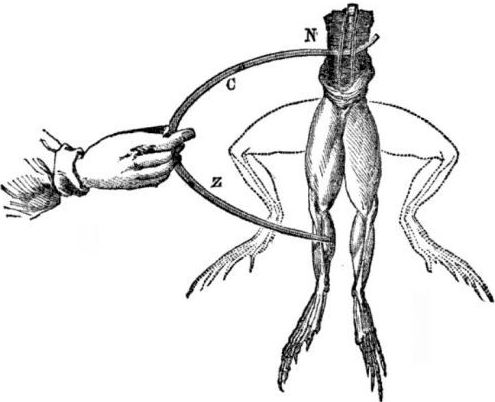
Nakon Galvanijeve smrti, njegov suvremenik Alessandro Volta, kao kemičar i fizičar, opisat će i javno pokazati realniji mehanizam nastanka električne struje kada različiti metali dođu u kontakt.
Volta će, nakon niza eksperimenata, doći do nedvosmislenog zaključka da se struja pojavljuje u krugu zbog prisutnosti u njoj dva vodiča različitih metala smještenih u tekućini, a to uopće nije "životinjska struja", kako je Galvani mislio. Trzanje nogu žabe bilo je posljedica djelovanja struje koja nastaje iz dodira različitih metala (bakrene kuke i čelični skalpel).
Volta će pokazati iste pojave koje je Galvani pokazivao na mrtvoj žabi, ali na potpuno neživom domaćem elektrometru, a 1800. godine dat će precizno objašnjenje struje: „drugorazredni dirigent (tekućina) je u sredini i dodiruje dva prvoklasna vodiča dva različita metali ... Kao rezultat toga nastaje električna struja u jednom ili drugom smjeru. "

U jednom od prvih pokusa Volta je spustio dvije ploče - cink i bakar - u staklenku s kiselinom i povezao ih žicom. Nakon toga, cink ploča se počela otapati, a na bakrenom čeliku formirali su se mjehurići plina. Volta je predložio i dokazao da električna struja teče kroz žicu.
Tako je izumljen "Volta element" - prva galvanska stanica. Radi praktičnosti, Volta mu je dao oblik vertikalnog cilindra (stupa), koji se sastojao od međusobno povezanih prstenova cinka, bakra i tkanine impregnirane kiselinom. Stup od volta visok pola metra stvorio je napon osjetljiv na ljude.
Od početka istraživanja položio je Luigi Galvani, ime kemijski izvor struje sačuvao uspomenu na njega u njegovo ime.
Galvanska ćelija Je kemijski izvor električne struje, koji se temelji na interakciji dvaju metala i / ili njihovih oksida u elektrolitu, što dovodi do pojave električne struje u zatvorenom krugu. Tako se u galvanskim ćelijama kemijska energija pretvara u električnu.
Ćelije danas

Stanice se danas nazivaju baterije. Tri su vrste baterije široko rasprostranjene: fiziološka (suha), alkalna (nazivaju se i alkalna, „alkalna“ u prijevodu s engleskog - „alkalna“) i litijska. Princip njihovog rada isti je kao što je Volta opisao 1800. godine: dva metala međusobno komuniciraju kroz elektrolit, a u vanjskom zatvorenom krugu nastaje električna struja.
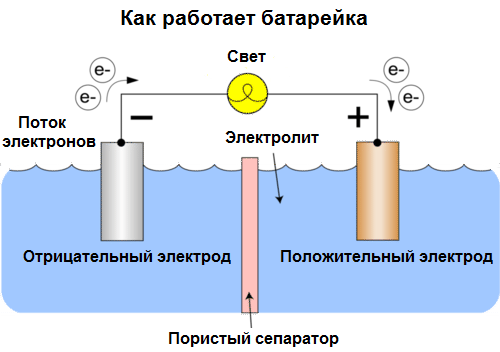
Napon baterije ovisi o korištenim metalima i o broju ćelija u "bateriji". Baterije, za razliku od baterija, nisu sposobne vratiti svoja svojstva, jer izravno pretvaraju kemijsku energiju, tj. Energiju reagensa (reduknata i oksidansa) koji čine bateriju, u električnu energiju.
Reagenti koji su uključeni u bateriju troše se tijekom njenog rada, struja se postupno smanjuje, pa djelovanje izvora prestaje nakon što reagensi potpuno reagiraju.
Alkalni i solni elementi (baterije) naširoko se koriste za napajanje raznih elektroničkih uređaja, radijske opreme, igračaka, a litij se najčešće može naći u prijenosnim medicinskim uređajima poput mjerača glukoze u krvi ili u digitalnoj tehnologiji, poput kamera.

Slane baterije
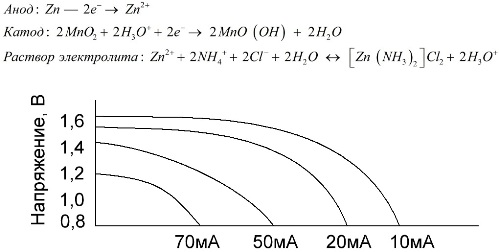
Mangan-cink stanice, koje se nazivaju baterijama soli, su "suhe" galvanske ćelije, unutar kojih nema otopine tekućeg elektrolita.
Cink elektroda (+) je katoda u obliku čaše, a prašna mješavina manganovog dioksida s grafitom služi kao anoda. Struja teče kroz grafitnu šipku. Kao elektrolit koristi se pasta iz otopine amonijevog klorida s dodatkom škroba ili brašna da se zgusne, tako da ništa ne teče.
Proizvođači baterija obično ne navode točan sastav elemenata soli, međutim, slane baterije su najjeftinije, obično se koriste u uređajima gdje je potrošnja energije izuzetno mala: u satima, na daljinskim upravljačima, u elektronskim termometrima itd.

Koncept "nominalnog kapaciteta" rijetko se koristi za karakterizaciju mangan-cinkovih baterija, jer je njihov kapacitet uvelike ovisan o radnim uvjetima i uvjetima. Glavni nedostaci ovih elemenata su značajna brzina smanjenja napona tijekom pražnjenja i značajno smanjenje izlazne kapacitete s povećanjem struje pražnjenja. Konačni napon pražnjenja postavlja se ovisno o opterećenju u rasponu od 0,7-1,0 V.
Važna je ne samo veličina struje pražnjenja, već i vremenski raspored opterećenja. S povremenim pražnjenjem velikih i srednjih struja, performanse baterija značajno se povećavaju u usporedbi s neprekidnim radom. Međutim, s malim strujama pražnjenja i mjesečnim prekidima u radu, njihov kapacitet može se smanjiti kao rezultat samo-pražnjenja.
Gornji graf prikazuje krivulje pražnjenja za prosječnu bateriju soli za 4, 10, 20 i 40 sati za usporedbu s alkalnom, o čemu će biti govora kasnije.
Alkalne (alkalne) baterije
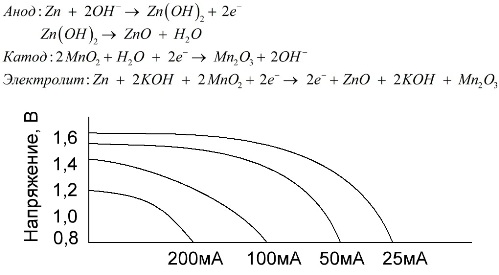
Alkalna baterija je galvanska baterija od mangana i cinka, u kojoj se mangan dioksid koristi kao katoda, cink u prahu koristi se kao anoda, a alkalna otopina koristi se kao elektrolit, obično u obliku paste kalijevog hidroksida.
Ove baterije imaju niz prednosti (posebno značajno veći kapacitet, bolje performanse pri niskim temperaturama i strujama visokog opterećenja).

Alkalne baterije, u usporedbi s fiziološkom otopinom, mogu dugotrajno pružiti više struje. Veća struja postaje moguća jer se cink ovdje koristi ne u obliku čaše, već u obliku praha koji ima veće kontaktno područje s elektrolitom. Kalijev hidroksid u obliku paste koristi se kao elektrolit.
Zahvaljujući sposobnosti ove vrste galvanskih ćelija dugo vremena isporučuju značajnu struju (do 1 A), alkalne baterije su trenutno najčešće.
U električnim igračkama, u prijenosnoj medicinskoj opremi, u elektroničkim uređajima, fotoaparatima, svugdje se koriste alkalne baterije. Oni služe 1,5 puta duže od fiziološke otopine ako je pražnjenje malo struje. Grafikon prikazuje krivulje pražnjenja pri različitim strujama za usporedbu sa slanom baterijom (graf je dan gore) u trajanju od 4, 10, 20 i 40 sati.
Litijske baterije
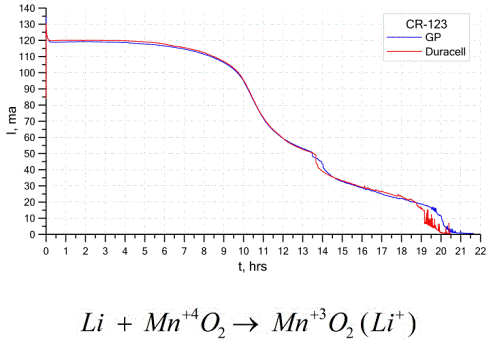
Druga prilično uobičajena vrsta galvanskih ćelija su litijeve baterije - pojedinačne ne punjive galvanske ćelije u kojima se litij ili njegovi spojevi koriste kao anoda. Zbog upotrebe alkalnih metala imaju veliku potencijalnu razliku.

Katod i elektrolit litijske ćelije mogu biti vrlo različiti, pa izraz „litijska ćelija“ kombinira skupinu ćelija s istim anodnim materijalom.Kao katoda mogu se koristiti, na primjer, mangan dioksid, ugljični monofluorid, pirit, tionil klorid itd.
Litijeve baterije razlikuju se od ostalih baterija po visokoj vremenu trajanja i visokim troškovima. Ovisno o odabranoj veličini i kemijskim materijalima, litijska baterija može stvoriti napon od 1,5 V (kompatibilno s alkalnim baterijama) do 3,7 V.
Ove baterije imaju najveći kapacitet po jedinici mase i dug vijek trajanja. Litijske ćelije naširoko se koriste u modernoj prijenosnoj elektroničkoj opremi: za napajanje satova na matičnim pločama računala, za napajanje prijenosnih medicinskih uređaja, satova, kalkulatora, u fotografskoj opremi itd.
Gornji grafikon prikazuje krivulje pražnjenja za dvije litijeve baterije dvaju popularnih proizvođača. Početna struja bila je 120 mA (po otporniku reda 24 Ohma).
Vidi također: Moderne punjive baterije - prednosti i nedostaci
Pogledajte također na elektrohomepro.com
: