kategorije: Početnici električari, Industrijski električar
Broj pregledavanja: 37528
Komentari na članak: 0
Praktična primjena elektrolize
Kad električna struja prođe kroz otopinu ili talinu elektrolita, na elektrode se oslobađaju otopljene elektrode ili druge tvari koje su produkti sekundarnih reakcija na elektrodama. Ovaj fizikalno-kemijski proces naziva se elektroliza.
Bit elektrolize
U električnom polju koje stvaraju elektrode ioni u vodljivoj tekućini dolaze redom. Negativna elektroda je katoda, pozitivna je anoda.
Negativni ioni zvani anioni (ioni hidroksilne skupine i kiselinski ostaci) jure prema anodi, a pozitivni ioni zvani kationi (vodik, metal, amonijevi ioni itd.) Jure prema katodi
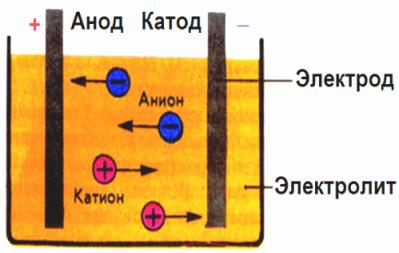
Na elektrodama se odvija proces redukcije oksidacije: na katodi dolazi do elektrokemijske redukcije čestica (atoma, molekula, kationa), a na anodi dolazi do elektrokemijske oksidacije čestica (atoma, molekula, aniona). Reakcije disocijacije u elektrolitu primarne su reakcije, a reakcije koje teku izravno na elektrodama nazivaju se sekundarnim.
Zakoni Faradayeve elektrolize
Razdvajanje reakcija elektrolize na primarne i sekundarne pomoglo je Michaelu Faradayu da uspostavi zakone elektrolize:
-
Prvi zakon Faradayeve elektrolize: masa tvari deponirane na elektrodi tijekom elektrolize izravno je proporcionalna količini električne energije koja se prenosi na ovu elektrodu. Pod količinom električne energije podrazumijeva se električni naboj, koji se u pravilu mjeri u privjescima.
-
Drugi zakon Faradayeve elektrolize: za određenu količinu električne energije (električni naboj) masa kemijskog elementa koji se taloži na elektrodi izravno je proporcionalna ekvivalentnoj masi elementa. Ekvivalentna masa tvari je njena molarna masa podijeljena s cijelim brojem, ovisno o kemijskoj reakciji u kojoj je tvar uključena.
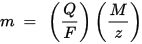
m je masa tvari taložene na elektrodi, Q je ukupni električni naboj koji prolazi kroz tvar F = 96,485.33 (83) C mol - 1 je Faradayeva konstanta, M je molarna masa tvari (Na primjer, molarna masa vode H2O = 18 g / mol), z valencijski broj iona neke tvari (broj elektrona po ionu).
Imajte na umu da je M / z ekvivalentna masa istaložene tvari. Za prvi Faradayev zakon M, F i z su konstante, pa što je veća vrijednost Q, veća je vrijednost m. Za drugi Faradayev zakon Q, F i z su konstante, pa što je veća vrijednost M / z (ekvivalentna masa), veća je vrijednost m.
Elektroliza se danas široko koristi u industriji i tehnologiji. Na primjer, elektroliza služi kao jedna od najučinkovitijih metoda za industrijsku proizvodnju vodika, vodikovog peroksida, manganovog dioksida, aluminija, natrija, magnezija, kalcija i drugih tvari. Elektroliza se koristi za pročišćavanje otpadnih voda, galvanskih prevlaka, galvaniziranja i konačno u izvorima kemijskih struja. Ali prvo stvari.
Dobivanje čistih metala iz ruda elektrolizom
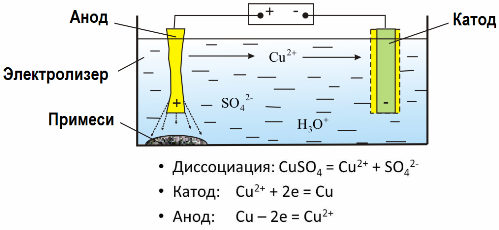
Zahvaljujući elektrolizi, mnogi se metali izvlače iz ruda i podvrgavaju daljnjoj obradi. Dakle, kada se ruda ili obogaćena ruda - koncentrat - tretiraju s reagensima, metal prelazi u otopinu, a zatim se elektroekstracijom metal izolira iz otopine. Čisti metal otpušta se istodobno na katodi. Na ovaj način primajte cink, bakar, kadmij.
Metali su podvrgnuti elektrorefiniranju kako bi se uklonile nečistoće i pretvorile sadržane nečistoće u oblik pogodan za daljnju obradu. Metal koji se čisti mora biti lijevan u obliku ploča, a te se ploče koriste kao anode u elektrolizi.
Kad struja prođe, metal anode se rastopi, prelazi u obliku kationa u otopinu, tada se katodi odbacuju na katodu i formiraju talog od čistog metala. Nečistoće anode se ne rastvaraju - talože se s anodnom suspenzijom ili prelaze u elektrolit, odakle se kontinuirano ili periodično uklanjaju.
Razmotrite kao primjer bakarno elektrorefiniranje, Glavna komponenta otopine - bakreni sulfat - najčešća i najjeftinija sol ovog metala. Otopina ima malu električnu vodljivost. Da biste ga povećali, u elektrolit se dodaje sumporna kiselina.
Osim toga, male količine aditiva uvode se u otopinu kako bi se olakšalo stvaranje kompaktnog metalnog taloga. Općenito, bakar, nikal, olovo, kositar, srebro i zlato podvrgavaju se elektrolitskom rafiniranju.
Elektroliza Pročišćavanje otpadnih voda
Elektroliza se koristi u obradi otpadnih voda (procesi elektrokoagulacije, elektroekstrakcije i elektroflotacije). Metoda elektrokemijskog čišćenja jedna je od najčešće korištenih. Za elektrolizu koriste se netopive anode (magnetit, olovni oksid, grafit, mangan, koji se talože na bazi titana) ili topljivi (aluminij, željezo).
Ova metoda koristi se za izoliranje toksičnih organskih i anorganskih tvari iz vode. Na primjer, bakrene cijevi očiste se od kamenca otopinom sumporne kiseline, a industrijske otpadne vode moraju se očistiti elektrolizom s netopljivom anodom. Na katodi se oslobađa bakar koji se opet može koristiti u istom poduzeću.
Alkalne otpadne vode pročišćuju se elektrolizom iz cijanidnih spojeva. Kako bi se ubrzala oksidacija cijanida, povećala električna vodljivost i uštedjela energija, aditiv u obliku natrijevog klorida koristi se u vodi.
Elektroliza se vrši grafitnom anodom i čeličnom katodom. Cijanidi se uništavaju tijekom elektrokemijske oksidacije i klora, koji se oslobađa na anodi. Učinkovitost takvog čišćenja je blizu 100%.
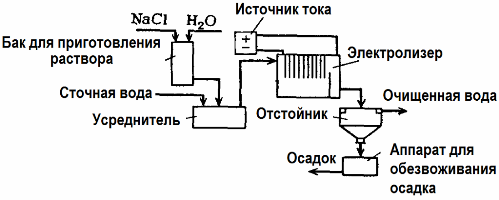
Osim izravnog elektrokemijskog čišćenja, može se uključiti u proces elektrolize koagulacija, Izuzev dodavanja soli, elektroliza se provodi s topljivim aluminijevim ili željeznim anodama. Tada se uništavaju ne samo onečišćenja na anodi, već se i sama anoda otapa. Nastaju aktivni dispergirani spojevi koji koaguliraju (zadebljaju) koloidno dispergirane kontaminante.
Ova metoda je učinkovita u pročišćavanju otpadnih voda iz masti, naftnih proizvoda, boja, ulja, radioaktivnih tvari itd. Zove se elektrokoagulacija.
pocinčavanja
Elektroplatiranje je elektrolitičko taloženje određenih metala kako bi se proizvodi zaštitili od korozije i dali im odgovarajući estetski izgled (premaz je izrađen kromom, niklom, srebrom, zlatom, platinom itd.). Stvar se temeljito čisti, odmašćuje i koristi kao katoda u elektrolitičkoj kupki u koju se ulijeva solna otopina metala s kojom je potrebno premazati proizvod.
Ploča od istog metala koristi se kao anoda. U pravilu se koristi par anodnih ploča, a predmet koji treba pocinčati postavlja se između njih.
galvanoplastics
Galvansko prevlačenje - taloženje metala na površini različitih tijela kako bi se reproducirali njihovi oblici: kalupi za lijevanje dijelova, skulpture, tiskani klišei itd.

Taloženje galvanizacije metala na površini predmeta moguće je samo ako je ta površina ili čitav objekt provodnik električne struje, pa je za izradu modela ili oblika preporučljivo koristiti metale. U tu svrhu su najprikladniji topljivi metali: olovo, kositar, lemilice, drvena legura.
Ovi metali su mekani, lako se obrađuju alatima za obradu metala, dobro su urezani i lijevani. Nakon nanošenja galvanskog sloja i završne obrade, metalni kalup se odlijeva iz gotovog proizvoda.
Najveće mogućnosti izrade modela i dalje predstavljaju dielektrični materijali. Za metaliziranje takvih modela potrebno je dati njihovu površinsku električnu vodljivost. Uspjeh ili neuspjeh u konačnici ovisi uglavnom o kvaliteti vodljivog sloja. Ovaj sloj se može nanositi na jedan od tri načina.
Najčešći način je grafitirovanie, pogodan je za modele plastelina i drugih materijala koji omogućuju brušenje grafita po površini.
Sljedeći trik je brončani, metoda je dobra za modele relativno složenog oblika, za različite materijale, međutim, zbog debljine sloja bronce, prijenos malih dijelova je pomalo poremećen.
I konačno posrebrivanjepogodan u svim slučajevima, ali posebno nezamjenjiv za krhke modele vrlo složenog oblika - biljke, insekte itd.
Kemijski izvori struje
Također, elektroliza je glavni proces zbog kojeg djeluju najnapredniji kemijski izvori struje, poput baterija i akumulatora. Dvije elektrode su u kontaktu s elektrolitom.
Postavlja se potencijalna razlika između elektroda - elektromotorne sile koja odgovara slobodnoj energiji redoks reakcije. Pogledajte ovdje za više detalja: Kemijski izvori električne struje
Limunska baterija (kliknite na sliku za povećanje)
Djelovanje izvora kemijskih struja temelji se na nastanku prostorno razdvojenih procesa s zatvorenim vanjskim krugom: na negativnoj anodi reducirajuće sredstvo oksidira, slobodni elektroni koji nastaju prolaze kroz vanjski krug do pozitivnog katoda, stvarajući struju pražnjenja, gdje sudjeluju u reakciji smanjenja oksidacije. Dakle, protok negativno nabijenih elektrona duž vanjskog kruga ide od anode do katode, to jest od negativne elektrode do pozitivne.
Pogledajte također na elektrohomepro.com
: