categorieën: Beginnende elektriciens, Industrieel elektricien
Aantal keer bekeken: 37528
Reacties op het artikel: 0
De praktische toepassing van elektrolyse
Wanneer een elektrische stroom door een oplossing of een smelt van elektrolyt stroomt, komen de opgeloste stoffen of andere stoffen die het product zijn van secundaire reacties op de elektroden vrij op de elektroden. Dit fysicochemische proces wordt elektrolyse genoemd.
De essentie van elektrolyse
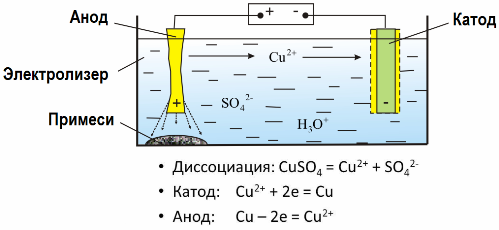
In het elektrische veld dat door de elektroden wordt gecreëerd, komen de ionen in de geleidende vloeistof in een geordende beweging. De negatieve elektrode is de kathode, de positieve is de anode.
Negatieve ionen genaamd anionen (ionen van de hydroxylgroep en zuurresten) snellen naar de anode, en positieve ionen genaamd kationen (waterstof, metaal, ammoniumionen, enz.) Snellen naar de kathode
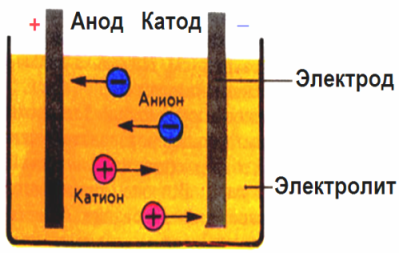
Een oxidatie-reductieproces vindt plaats bij de elektroden: elektrochemische reductie van deeltjes (atomen, moleculen, kationen) vindt plaats bij de kathode en elektrochemische oxidatie van deeltjes (atomen, moleculen, anionen) vindt plaats bij de anode. Dissociatiereacties in een elektrolyt zijn primaire reacties en reacties die direct op de elektroden plaatsvinden, worden secundair genoemd.
De wetten van de elektrolyse van Faraday
De scheiding van elektrolysereacties in primaire en secundaire hielp Michael Faraday om de wetten van elektrolyse vast te stellen:
-
De eerste wet van de elektrolyse van Faraday: de massa van de stof die tijdens de elektrolyse op de elektrode wordt afgezet, is recht evenredig met de hoeveelheid elektriciteit die naar deze elektrode wordt overgebracht. Met de hoeveelheid elektriciteit wordt een elektrische lading bedoeld, in de regel gemeten in hangers.
-
De tweede wet van Faraday-elektrolyse: voor een gegeven hoeveelheid elektriciteit (elektrische lading) is de massa van een chemisch element dat op de elektrode wordt afgezet rechtstreeks evenredig met de equivalente massa van het element. De equivalente massa van een stof is de molaire massa gedeeld door een geheel getal, afhankelijk van de chemische reactie waarbij de stof betrokken is.
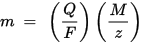
m is de massa van de stof die is afgezet op de elektrode, Q is de totale elektrische lading die door de stof gaat F = 96.485,33 (83) C mol - 1 is de Faraday-constante, M is de molaire massa van de stof (bijvoorbeeld de molaire massa van water H2O = 18 g / mol), z is het valentie-aantal ionen van een stof (het aantal elektronen per ion).
Merk op dat M / z de equivalente massa van de geprecipiteerde stof is. Voor de eerste Faraday-wet zijn M, F en z constanten, dus hoe groter de waarde van Q, hoe groter de waarde van m. Voor de tweede Faraday-wet zijn Q, F en z constanten, dus hoe groter de waarde van M / z (equivalente massa), hoe groter de waarde van m.
Elektrolyse wordt tegenwoordig veel gebruikt in de industrie en in de technologie. Elektrolyse is bijvoorbeeld een van de meest efficiënte methoden voor de industriële productie van waterstof, waterstofperoxide, mangaandioxide, aluminium, natrium, magnesium, calcium en andere stoffen. Elektrolyse wordt gebruikt om afvalwater te behandelen, bij galvaniseren, bij galvaniseren en ten slotte in chemische bronnen. Maar eerst dingen eerst.
Het verkrijgen van zuivere metalen uit ertsen door elektrolyse
Dankzij elektrolyse worden veel metalen gewonnen uit ertsen en verder verwerkt. Dus, wanneer erts of verrijkt erts - concentraat - wordt behandeld met reagentia, gaat het metaal in de oplossing en vervolgens wordt het metaal uit de oplossing geëxtraheerd door elektro-extractie. Zuiver metaal komt tegelijkertijd vrij bij de kathode. Op deze manier ontvangt u zink, koper, cadmium.
Metalen worden onderworpen aan elektroraffinage om onzuiverheden te verwijderen en de aanwezige onzuiverheden om te zetten in een vorm die geschikt is voor verdere verwerking. Het te reinigen metaal wordt gegoten in de vorm van platen en deze platen worden gebruikt als anoden bij elektrolyse.
Wanneer de stroom passeert, lost het metaal van de anode op, gaat het in de vorm van kationen in de oplossing, dan worden de kationen aan de kathode ontladen en vormen een neerslag van zuiver metaal. Onzuiverheden van de anode lossen niet op - ze slaan neer met anodeslib of gaan over in de elektrolyt, vanwaar ze continu of periodiek worden verwijderd.
Beschouw als een voorbeeld koper electrorefining. Het hoofdbestanddeel van de oplossing - kopersulfaat - het meest voorkomende en goedkoopste zout van dit metaal. De oplossing heeft een lage elektrische geleidbaarheid. Om het te verhogen, wordt zwavelzuur aan de elektrolyt toegevoegd.
Bovendien worden kleine hoeveelheden additieven aan de oplossing toegevoegd om de vorming van een compact metaalneerslag te vergemakkelijken. In het algemeen worden koper, nikkel, lood, tin, zilver en goud onderworpen aan elektrolytische raffinage.
Elektrolyse Afvalwaterzuivering
Elektrolyse wordt gebruikt bij de behandeling van afvalwater (processen van elektrocoagulatie, elektro-extractie en elektroflotatie). De elektrochemische reinigingsmethode is een van de meest gebruikte. Voor elektrolyse worden onoplosbare anoden (magnetiet, loodoxide, grafiet, mangaan, die op een titaanbasis worden afgezet) of oplosbaar (aluminium, ijzer) gebruikt.
Deze methode wordt gebruikt om giftige organische en anorganische stoffen uit water te isoleren. Koperen leidingen worden bijvoorbeeld met een oplossing van zwavelzuur van kalk verwijderd en industrieel afvalwater moet vervolgens worden gereinigd door elektrolyse met een onoplosbare anode. Koper komt vrij bij de kathode, die opnieuw in dezelfde onderneming kan worden gebruikt.
Alkalisch afvalwater wordt gezuiverd door elektrolyse uit cyanideverbindingen. Om de oxidatie van cyaniden te versnellen, de elektrische geleidbaarheid te verhogen en energie te besparen, wordt een additief in de vorm van natriumchloride in water gebruikt.
Elektrolyse wordt uitgevoerd met een grafietanode en een stalen kathode. Cyaniden worden vernietigd tijdens elektrochemische oxidatie en chloor, dat vrijkomt op de anode. De effectiviteit van een dergelijke reiniging is bijna 100%.
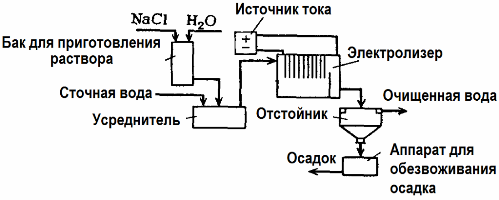
Naast directe elektrochemische reiniging kan het worden opgenomen in het elektrolyseproces stolling. Exclusief toevoeging van zouten wordt elektrolyse uitgevoerd met oplosbare aluminium- of ijzeranoden. Dan worden niet alleen de verontreinigingen op de anode vernietigd, maar lost de anode zelf op. Actieve gedispergeerde verbindingen worden gevormd die colloïdale gedispergeerde verontreinigingen coaguleren (verdikken).
Deze methode is effectief bij het behandelen van afvalwater van vetten, olieproducten, kleurstoffen, oliën, radioactieve stoffen, enz. Het wordt elektrocoagulatie genoemd.
verzinken
Galvaniseren is de elektrolytische afzetting van bepaalde metalen om producten tegen corrosie te beschermen en ze een passend esthetisch uiterlijk te geven (coating wordt gemaakt met chroom, nikkel, zilver, goud, platina, enz.). Het ding wordt grondig gereinigd, ontvet en gebruikt als een kathode in een elektrolytisch bad waarin een zoutoplossing van het metaal waarmee het product moet worden bedekt, wordt gegoten.
Een plaat van hetzelfde metaal wordt gebruikt als de anode. In de regel wordt een paar anodeplaten gebruikt en wordt het te verzinken onderwerp daartussen geplaatst.
galvanoplastics
Galvaniseren - de afzetting van metaal op het oppervlak van verschillende lichamen om hun vormen te reproduceren: mallen voor het gieten van onderdelen, sculpturen, bedrukte clichés, enz.

Galvanische depositie van metaal op het oppervlak van een object is alleen mogelijk wanneer dit oppervlak of het gehele object een elektrische stroomgeleider is, dus het is raadzaam om metalen te gebruiken om modellen of vormen te maken. Smeltbare metalen zijn het meest geschikt voor dit doel: lood, tin, soldeer, houtlegering.
Deze metalen zijn zacht, gemakkelijk te verwerken met metaalbewerkingsgereedschap, zijn goed gegraveerd en gegoten. Na het opbouwen van de galvanische laag en afwerking, wordt het vormmetaal gesmolten uit het eindproduct.
De grootste kansen voor productiemodellen worden echter nog steeds vertegenwoordigd door diëlektrische materialen. Om dergelijke modellen te metalliseren, is het noodzakelijk om hun elektrische geleidbaarheid aan het oppervlak te geven. Succes of falen hangt uiteindelijk vooral af van de kwaliteit van de geleidende laag. Deze laag kan op drie manieren worden aangebracht.
De meest voorkomende manier is grafitirovanie, het is geschikt voor modellen van plasticine en andere materialen waarmee grafiet op het oppervlak kan worden gemalen.
De volgende truc is bronzing, de methode is goed voor modellen met een relatief complexe vorm, voor verschillende materialen, maar door de dikte van de bronzen laag is de overdracht van kleine details enigszins vervormd.
En eindelijk verzilveringgeschikt in alle gevallen, maar vooral onmisbaar voor fragiele modellen met een zeer complexe vorm - planten, insecten, enz.
Chemische stroombronnen
Elektrolyse is ook het belangrijkste proces waardoor de meest geavanceerde chemische stroombronnen, zoals batterijen en accu's, werken. Er zijn twee elektroden in contact met de elektrolyt.
Er wordt een potentiaalverschil vastgesteld tussen de elektroden - een elektromotorische kracht die overeenkomt met de vrije energie van de redoxreactie. Zie hier voor meer informatie: Chemische bronnen van elektrische stroom
Citroenbatterij (klik op de afbeelding om te vergroten)
De werking van chemische stroombronnen is gebaseerd op het optreden van ruimtelijk gescheiden processen met een gesloten extern circuit: op de negatieve anode wordt het reductiemiddel geoxideerd, de vrije elektronen die worden gevormd, passeren het externe circuit naar de positieve kathode, waardoor een ontladingsstroom ontstaat, waar ze deelnemen aan de oxidatiereductiereactie. Aldus gaat de stroom van negatief geladen elektronen langs het externe circuit van de anode naar de kathode, dat wil zeggen van de negatieve elektrode naar de positieve.
Zie ook op i.electricianexp.com
: