categorieën: Aanbevolen artikelen » Beginnende elektriciens
Aantal keer bekeken: 36288
Reacties op het artikel: 1
Chemische stroombronnen: hoofdkenmerken
 Al meer dan twee eeuwen gebruikt de mens de energie van chemische reacties tussen verschillende stoffen om gelijkstroom te produceren.
Al meer dan twee eeuwen gebruikt de mens de energie van chemische reacties tussen verschillende stoffen om gelijkstroom te produceren.
Werkingsprincipe
De redoxreactie die optreedt tussen stoffen met de eigenschappen van een oxidatiemiddel en een reductiemiddel gaat gepaard met de afgifte van elektronen, waarvan de beweging een elektrische stroom vormt. Om zijn energie te gebruiken, is het echter noodzakelijk om voorwaarden te creëren voor de doorgang van elektronen door een extern circuit; anders wordt het vrijgegeven door warmte uit een eenvoudig mengsel van een oxidatiemiddel en een reductiemiddel.
Daarom hebben alle chemische stroombronnen twee elektroden:
-
de anode waarop oxidatie optreedt;
-
kathode, die het herstel van de stof uitvoert.
Elektroden op afstand worden in een vat met een elektrolyt geplaatst - een stof die elektrische stroom geleidt vanwege de dissociatieprocessen van het medium in ionen.
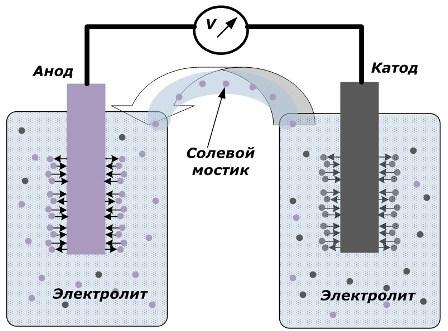
Het principe van het omzetten van chemische energie in elektrische energie
De figuur toont dat de elektroden in afzonderlijke vaten zijn geplaatst die zijn verbonden door een zoutbrug waardoor de beweging van ionen langs het interne circuit wordt gecreëerd. Wanneer de externe en interne circuits open zijn, vinden er twee processen op de elektroden plaats: de overgang van ionen van het metaal van de elektrode naar de elektrolyt en de overgang van ionen van de elektrolyt naar het kristalrooster van de elektroden.
De stroomsnelheden van deze processen zijn hetzelfde en de spanningspotentialen van tegengestelde tekens worden op elke elektrode verzameld. Als ze zijn verbonden via een zoutbrug en er een belasting wordt uitgeoefend, treedt er een elektrisch circuit op. Een interne stroom wordt gegenereerd door de beweging van ionen tussen de elektroden door de elektrolyt en de zoutbrug. De beweging van elektronen langs het externe circuit in de richting van de anode naar de kathode.
Bijna alle redoxreacties gaan gepaard met elektriciteitsopwekking. Maar de waarde ervan is afhankelijk van vele factoren, waaronder de volumes en massa's van de gebruikte chemicaliën, de materialen die worden gebruikt om de elektroden te maken, zoals elektrolyt, ionconcentratie, ontwerp.
De meest gebruikte in moderne chemische bronnen zijn:
-
voor het materiaal van de anode (reductiemiddel), zink (Zn), lood (Pb), cadmium (Cd) en sommige andere metalen;
-
voor het kathodemateriaal (oxidatiemiddel) - loodoxide PbO2, mangaanoxide MnO2, nikkelhydroxide NiOOH en andere;
-
elektrolyten op basis van oplossingen van zuren, alkaliën of zouten.
Classificatie methoden
Het ene deel van chemische energiebronnen kan worden hergebruikt, het andere niet. Dit principe wordt als basis voor hun classificatie genomen.
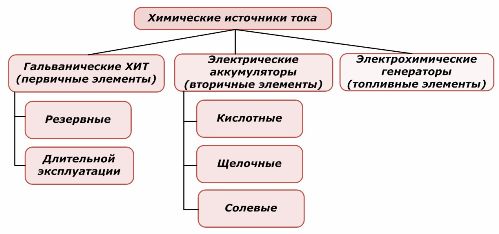
Classificatie van chemische elementen
Elektromotorische kracht galvanische cellen, afhankelijk van het ontwerp, bereikt 1,2 ÷ 1,5 volt. Om grote waarden te verkrijgen, worden ze gecombineerd tot batterijen die in serie worden verbonden. Wanneer de batterijen parallel zijn aangesloten, nemen de stroom en het vermogen toe.
Algemeen wordt aanvaard dat primaire chemische stroombronnen het opladen niet ondersteunen, hoewel deze positie nauwkeuriger kan worden geformuleerd: de implementatie ervan is economisch niet haalbaar.
Redundante primaire chemische stroombronnen worden opgeslagen in een toestand waarin de elektrolyt is geïsoleerd van de elektroden. Dit elimineert het optreden van de redoxreactie en zorgt voor gereedheid voor inbedrijfstelling. Ze worden niet hergebruikt. De houdbaarheid van chemische back-upstroombronnen is beperkt tot 10-15 jaar.
Batterijen worden met succes opgeladen door externe elektrische energie toe te passen. Vanwege deze functie worden ze secundaire stroombronnen genoemd. Ze zijn bestand tegen honderden en duizenden laad-ontlaadcycli.De EMF van de batterij kan in het bereik van 1,0 ÷ 1,5 volt liggen. Ze worden ook gecombineerd tot batterijen.
Elektrochemische generatoren werken volgens het principe van galvanische cellen, maar om de elektrochemische reactie uit te voeren, komen stoffen van buitenaf en worden alle vrijgekomen producten uit de elektrolyt verwijderd. Hiermee kunt u een continu proces organiseren.
Belangrijkste prestatiekenmerken van chemische energiebronnen
1. De spanning op de open klemmen
Afhankelijk van het ontwerp kan een enkele bron slechts een bepaald potentiaalverschil creëren. Voor gebruik in elektrische apparaten worden ze gecombineerd tot batterijen.
2. Specifieke capaciteit
Gedurende een bepaalde tijd (in uren) kan een chemische stroombron een beperkte hoeveelheid stroom (in ampères) genereren, die wordt toegeschreven aan een gewichtseenheid of volume-eenheid.
3. Vermogensdichtheid
Het kenmerkt het vermogen van een gewichtseenheid of volume van een chemische stroombron om stroom te genereren die wordt gegenereerd door het product van spanning door stroomsterkte.
4. Duur van de operatie
Deze parameter wordt ook de vervaldatum genoemd.
5. De waarde van zelfontladingsstromen
Deze nevenprocessen van elektrochemische reacties leiden tot het verbruik van de actieve massa van de elementen, veroorzaken corrosie en verminderen de specifieke capaciteit.
6. Productprijs
Hangt af van het ontwerp, de gebruikte materialen en een aantal andere factoren.
De beste chemische stroombronnen zijn die met hoge waarden van de eerste vier parameters, en zelfontlading en kosten zijn laag.
Batterij laadprincipes
Onder de secundaire chemische stroombronnen worden ze steeds populairder. lithium ion modellen, die op grote schaal worden gebruikt om elektronische apparaten van stroom te voorzien. Ze gebruiken LiMO2 (M Co, Ni, Mn) als het materiaal van de positieve elektrode en grafiet als de negatieve.
Wanneer geladen, worden lithiumionen van de toegevoerde externe energie vrijgegeven uit het kathodemetaal, passeren het elektrolyt en dringen door in de ruimte tussen de grafietlagen en hopen zich daar op.
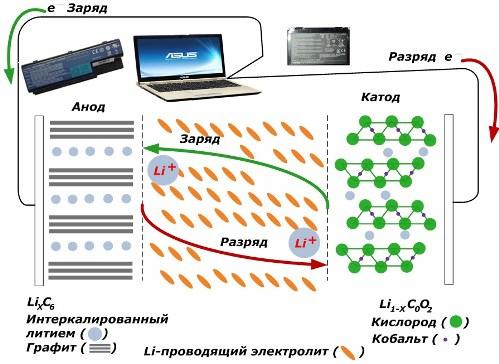
Wanneer de energie lader afwezig is en de belasting is verbonden met de elektroden, dan bewegen lithiumionen in de elektrolyt in de tegenovergestelde richting.
Als het laden en ontladen niet worden uitgevoerd, wordt de energie in de batterij niet verbruikt, maar opgeslagen. Maar de hoeveelheid wordt beperkt door de eigenschappen van de gebruikte materialen. In lithium-ionbatterijen is het specifieke elektrische vermogen bijvoorbeeld 130 ÷ 150 mAh / g. Het wordt beperkt door de eigenschappen van het anodemateriaal. Voor grafiet is de capaciteit ongeveer twee keer hoger.
Wetenschappers zoeken nu naar manieren om de batterijcapaciteit te vergroten en onderzoeken de mogelijkheid van een chemische reactie tussen lithium en zuurstof in de lucht. Om dit te doen, zijn ontwerpen ontwikkeld met een lucht, niet-vervangbare kathode, gebruikt in afzonderlijke batterijen. Deze methode kan de energiedichtheid tot 10 keer verhogen.
De werking van chemische stroombronnen vereist kennis grondbeginselen van elektrotechniek, elektrochemie, materiaalkunde en vaste-stoffysica.
Zie ook op bgv.electricianexp.com
:
