luokat: Esitetyt artikkelit » Aloittelijat
Katselukertoja: 36288
Kommentit artikkeliin: 1
Kemialliset virranlähteet: pääominaisuudet
 Ihmiskunta on käyttänyt yli kahden vuosisadan ajan eri aineiden välisten kemiallisten reaktioiden energiaa tasavirran tuottamiseksi.
Ihmiskunta on käyttänyt yli kahden vuosisadan ajan eri aineiden välisten kemiallisten reaktioiden energiaa tasavirran tuottamiseksi.
Toimintaperiaate
Hapettimen ja pelkistimen ominaisuuksilla olevien aineiden välillä tapahtuvaan redox-reaktioon liittyy elektronien vapautuminen, joiden liikkeet muodostavat sähkövirran. Sen energian käyttämiseksi on kuitenkin luotava olosuhteet elektronien kulkemiselle ulkoisen piirin läpi, muuten se vapautuu ulkoiseen ympäristöön yksinkertaisesti sekoittamalla hapettava aine ja pelkistävä aine lämmön kanssa.
Siksi kaikilla kemiallisilla virranlähteillä on kaksi elektrodia:
-
anodi, jolla tapahtuu hapettuminen;
-
katodi, joka suorittaa aineen pelkistyksen.
Etäisyyden päässä olevat elektrodit asetetaan astiaan elektrolyytin kanssa - aine, joka johtaa sähkövirtaa väliaineen dissosioitumisprosessien seurauksena ioneiksi.
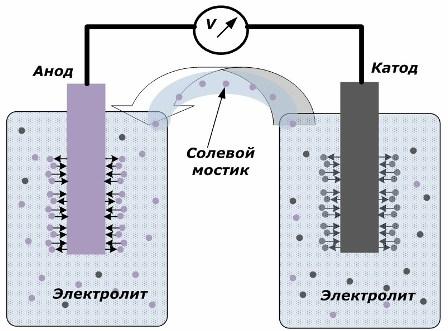
Periaate kemiallisen energian muuntamiseksi sähköenergiaksi
Kuvio osoittaa, että elektrodit on sijoitettu erillisiin astioihin, jotka on kytketty suolasillalla, jonka läpi ionien liikkuminen sisäpiiriä pitkin luodaan. Kun ulkoiset ja sisäiset piirit ovat avoinna, elektrodeissa tapahtuu kaksi prosessia: ionien siirtyminen elektrodimetallista elektrolyyttiin ja ionien siirtyminen elektrolyytistä elektrodien kidehilaan.
Näiden prosessien virtausnopeudet ovat samat ja vastakkaisten merkkien jännitepotentiaalit kertyvät jokaiselle elektrodille. Jos ne on kytketty suolasillan kautta ja kuormitus kohdistuu, tapahtuu sähköpiiri. Sisäinen virta syntyy ionien liikkeellä elektrodien välillä elektrolyytin ja suolaisen sillan läpi. Elektronien liike ulkoista virtapiiriä pitkin suunnassa anodista katodiin.
Lähes kaikkiin redox-reaktioihin liittyy sähköntuotanto. Mutta sen arvo riippuu monista tekijöistä, mukaan lukien käytettyjen kemikaalien määrät ja massat, elektrodien valmistukseen käytetyt materiaalit, kuten elektrolyytti, ionipitoisuus, suunnittelu.
Nykyaikaisissa kemiallisissa virtalähteissä käytetään eniten:
-
anodin materiaalille (pelkistävä aine) - sinkki (Zn), lyijy (Pb), kadmium (Cd) ja jotkut muut metallit;
-
katodimateriaalille (hapetin) - lyijyoksidi PbO2, mangaanioksidi MnO2, nikkelihydroksidi NiOOH ja muut;
-
happojen, emästen tai suolojen liuoksiin perustuvat elektrolyytit.
Luokitusmenetelmät
Yksi osa kemiallisista energialähteistä voidaan käyttää uudelleen, kun taas toinen ei. Tätä periaatetta käytetään niiden luokittelun perustana.
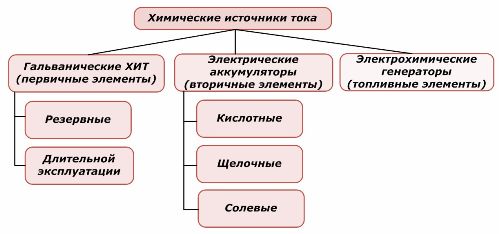
Kemiallisten alkuaineiden luokittelu
Sähkömoottorivoima galvaaniset solut, suunnittelusta riippuen, saavuttaa 1,2 ÷ 1,5 volttia. Suurten arvojen saamiseksi ne yhdistetään paristoihin, kytkettäessä sarjaan. Kun paristot kytketään samanaikaisesti, virta ja teho kasvaa.
On yleisesti hyväksyttyä, että primaariset kemialliset virtalähteet eivät tue lataamista, vaikka tarkemmin tämä kanta voidaan muotoilla eri tavalla: sen toteuttaminen ei ole taloudellisesti mahdollista.
Tarpeelliset primääriset kemialliset virtalähteet varastoidaan tilassa, jossa elektrolyytti on eristetty elektrodoista. Tämä eliminoi redox-reaktion esiintymisen ja varmistaa käyttövalmiuden. Niitä ei käytetä uudelleen. Kemiallisten varavirtalähteiden varastointiaika on rajoitettu 10–15 vuoteen.
Paristojen lataus onnistuu ulkoisen sähköenergian avulla. Tämän ominaisuuden vuoksi niitä kutsutaan toissijaisiksi virtalähteiksi. Ne kestävät satoja ja tuhansia varauksen purkausjaksoja.Akun EMF voi olla alueella 1,0 ÷ 1,5 volttia. Ne yhdistetään myös paristoiksi.
Sähkökemialliset generaattorit toimivat galvaanisten kennojen periaatteella, mutta sähkökemiallisen reaktion suorittamiseksi aineet tulevat ulkopuolelta ja kaikki vapautuneet tuotteet poistetaan elektrolyytistä. Tämän avulla voit järjestää jatkuvan prosessin.
Kemiallisten energialähteiden keskeiset suorituskykyominaisuudet
1. Jännite avoimien liittimien yli
Suunnittelusta riippuen yksi lähde voi luoda vain tietyn potentiaalieroon. Sähkölaitteissa käytettäväksi ne yhdistetään paristoiksi.
2. Erityinen kapasiteetti
Tietyn ajan (tunneissa) yksi kemiallinen virranlähde voi tuottaa rajoitetun määrän virtaa (ampeereina), joka määritetään paino- tai tilavuusyksiköksi.
3. Tehon tiheys
Se kuvaa kemiallisen virtalähteen painoyksikön tai tilavuusyksikön kykyä tuottaa jännitteen tuotteen tuottamaa energiaa virran voimakkuuden perusteella.
4. Operaation kesto
Tätä parametria kutsutaan myös viimeiseksi voimassaolopäiväksi.
5. Itsepurkausvirtajen arvo
Nämä sähkökemiallisten reaktioiden sivuprosessit johtavat elementtien aktiivisen massan kulutukseen, aiheuttavat korroosiota ja vähentävät ominaiskapasiteettia.
6. Tuotteen hinta
Riippuu suunnittelusta, käytetyistä materiaaleista ja monista muista tekijöistä.
Parhaita kemiallisia virtalähteitä ovat ne, joilla ensimmäisen neljän parametrin arvot ovat korkeat, ja itsepurkaus ja kustannukset ovat alhaiset.
Akun latausperiaatteet
Toissijaisista kemiallisista nykyisistä lähteistä ne ovat saavuttaneet suurta suosiota. litiumionimalleja, joita on tullut laajasti käyttämään elektronisten laitteiden virrankäyttöä. He käyttävät LiMO2: ta (M Co, Ni, Mn) positiivisen elektrodin materiaalina ja grafiittia negatiivisena elektrodina.
Ladattuaan käytetystä ulkoisesta energiasta peräisin olevat litiumionit vapautuvat katodimetallista, kulkevat elektrolyytin läpi ja tunkeutuvat grafiittikerrosten väliseen tilaan kertyen siihen.
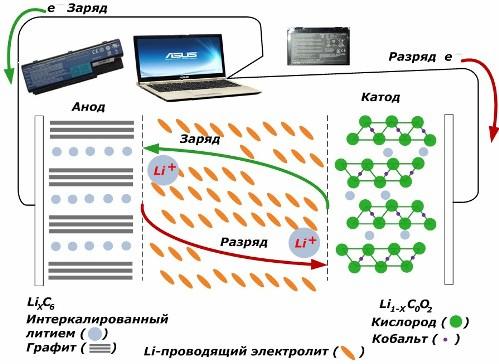
Kun energiaa laturi puuttuu, ja kuorma on kytketty elektrodeihin, sitten elektrolyytin litiumionit liikkuvat vastakkaiseen suuntaan.
Jos latausta ja purkamista ei suoriteta, akussa käytettyä energiaa ei kuluteta, vaan varastoidaan. Mutta sen määrää rajoittavat käytettyjen materiaalien ominaisuudet. Esimerkiksi litium-ioni-akkuissa spesifinen sähkökapasiteetti on 130 ÷ 150 mAh / g. Sitä rajoittavat anodimateriaalin ominaisuudet. Grafiitin kapasiteetti on noin kaksi kertaa suurempi.
Tutkijat etsivät nyt tapoja lisätä akun kapasiteettia, etsivät mahdollisuutta käyttää kemiallista reaktiota litiumin ja ilman hapen välillä. Tätä varten kehitetään malleja ilmaisella, kuluttamattomalla katodilla, jota käytetään erillisissä paristoissa. Tämä menetelmä voi lisätä energian tiheyttä jopa 10 kertaa.
Kemiallisten virtalähteiden toiminta vaatii tietoa sähkötekniikan perusteet, sähkökemia, materiaalitiede ja puolijohdefysiikka.
Katso myös osoitteesta i.electricianexp.com
:
