luokat: Aloittelijat, Teollisuuden sähköasentaja
Katselukertoja: 37528
Kommentit artikkeliin: 0
Elektrolyysin käytännön soveltaminen
Kun sähkövirta kulkee elektrolyytin liuoksen tai sulan läpi, liuenneet aineet tai muut aineet, jotka ovat elektrodien sekundaaristen reaktioiden tuotetta, vapautuvat elektrodoissa. Tätä fysikaalis-kemiallista prosessia kutsutaan elektrolyysiksi.
Elektrolyysin ydin
Elektrodien luomassa sähkökentässä johtavan nesteen ionit tulevat määrätyssä liikkeessä. Negatiivinen elektrodi on katodi, positiivinen on anodi.
Negatiivit ionit, joita kutsutaan anioneiksi (hydroksyyliryhmän ionit ja happotähteet), kiirehtivät anodiin, ja positiiviset ionit, joita kutsutaan kationeiksi (vety, metalli, ammoniumionit jne.), Kiirehtivät katodiin
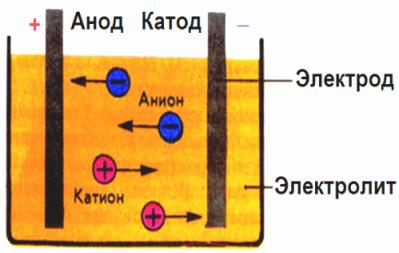
Hapetus-pelkistysprosessi tapahtuu elektrodeissa: hiukkasten (atomien, molekyylien, kationien) sähkökemiallinen pelkistys tapahtuu katodilla ja hiukkasten (atomien, molekyylien, anionien) sähkökemiallinen hapettuminen tapahtuu anodilla. Dissosiaatioreaktiot elektrolyytissä ovat primaarireaktioita, ja reaktioita, jotka etenevät suoraan elektrodeissa, kutsutaan sekundaarisiksi.
Faradayn elektrolyysin lait
Elektrolyysireaktioiden erottaminen primaariseksi ja sekundaariseksi auttoi Michael Faradaya laatimaan elektrolyysin lait:
-
Faraday-elektrolyysin ensimmäinen laki: elektrodille elektrolyysin aikana kerääntyneen aineen massa on suoraan verrannollinen tähän elektrodiin siirretyn sähkön määrään. Sähkömäärällä tarkoitetaan sähkövarausta, mitattuna pääsääntöisesti riipuksissa.
-
Faraday-elektrolyysin toinen laki: Tietylle määrälle sähköä (sähkövaraus) elektrodille kerrostuneen kemiallisen elementin massa on suoraan verrannollinen elementin vastaavaan massaan. Aineen ekvivalentti massa on sen moolimassa jaettuna kokonaisluvulla riippuen kemiallisesta reaktiosta, johon aine osallistuu.
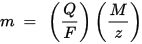
m on elektrodille kerrostuneen aineen massa, Q on aineen läpi kulkeva kokonais sähkövaraus F = 96,485,33 (83) C mol - 1 on Faradayn vakio, M on aineen moolimassa (esimerkiksi veden moolimassa H2O = 18 g / mol), z on aineen ionien valenssiluku (elektronien lukumäärä ionia kohti).
Huomaa, että M / z on saostuneen aineen vastaava massa. Ensimmäisessä Faraday-laissa M, F ja z ovat vakioita, joten mitä suurempi on Q-arvo, sitä suurempi on m-arvo. Toisessa Faraday-laissa Q, F ja z ovat vakioita, joten mitä suurempi M / z-arvo (ekvivalenttimassa), sitä suurempi on m-arvo.
Elektrolyysiä käytetään nykyään laajalti teollisuudessa ja tekniikassa. Esimerkiksi elektrolyysi toimii yhtenä tehokkaimmista menetelmistä vedyn, vetyperoksidin, mangaanidioksidin, alumiinin, natriumin, magnesiumin, kalsiumin ja muiden aineiden teollisessa tuotannossa. Elektrolyysiä käytetään jäteveden käsittelemiseen, galvanointiin, galvanointiin ja lopuksi kemiallisiin virranlähteisiin. Mutta ensin ensin.
Puhtaiden metallien saaminen malmeista elektrolyysillä
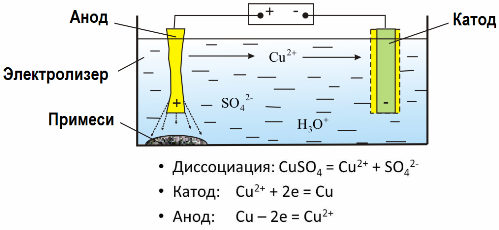
Elektrolyysin ansiosta monet metallit uutetaan malmeista ja käsitellään edelleen. Joten kun malmia tai rikastettua malmia - konsentraattia - käsitellään reagensseilla, metalli kulkee liuokseen, sitten metalli uutetaan liuoksesta sähköuutolla. Puhdas metalli vapautuu samaan aikaan katodilla. Tällä tavalla vastaan sinkki, kupari, kadmium.
Metallit puhdistetaan sähköllä epäpuhtauksien poistamiseksi ja sisältämien epäpuhtauksien muuttamiseksi sopivaan muotoon jatkokäsittelyä varten. Puhdistettava metalli on valettu levyjen muodossa, ja näitä levyjä käytetään anodeina elektrolyysissä.
Kun virta kulkee, anodin metalli liukenee, kulkee kationien muodossa liuokseen, sitten kationit purkautuvat katodilla ja muodostavat puhtaan metallin sakan. Anodin epäpuhtaudet eivät liukene - ne saostuvat anodilietteellä tai kulkeutuvat elektrolyyttiin, josta niitä poistetaan jatkuvasti tai määräajoin.
Tarkastelkaa esimerkkinä kuparin sähköhionta. Liuoksen pääkomponentti - kuparisulfaatti - on tämän metallin yleisin ja halvin suola. Ratkaisulla on alhainen sähkönjohtavuus. Sen lisäämiseksi elektrolyyttiin lisätään rikkihappoa.
Lisäksi liuokseen johdetaan pieniä määriä lisäaineita kompaktin metallisaostuman muodostumisen helpottamiseksi. Yleensä kupari, nikkeli, lyijy, tina, hopea ja kulta puhdistetaan elektrolyyttisesti.
Elektrolyysi-jäteveden käsittely
Elektrolyysiä käytetään jätevedenkäsittelyssä (sähkökoagulointi-, elektroekstraktio- ja elektroflotaatioprosessit). Sähkökemiallinen puhdistusmenetelmä on yksi yleisimmin käytetyistä. Elektrolyysiin käytetään liukenemattomia anodeja (magnetiitti, lyijyoksidi, grafiitti, mangaani, jotka kerrostuvat titaanipohjaan) tai liukoisia (alumiini, rauta).
Tätä menetelmää käytetään myrkyllisten orgaanisten ja epäorgaanisten aineiden eristämiseen vedestä. Esimerkiksi kupariputket puhdistetaan mittakaavassa rikkihappoliuoksella, ja sitten teollisuusjätevedet on puhdistettava elektrolyysillä liukenemattomalla anodilla. Kupari vapautetaan katodilla, jota voidaan jälleen käyttää samassa yrityksessä.
Alkalinen jätevesi puhdistetaan elektrolyysillä syanidiyhdisteistä. Syanidien hapettumisen nopeuttamiseksi, sähkönjohtavuuden lisäämiseksi ja energian säästämiseksi käytetään vedessä natriumkloridin muodossa olevaa lisäainetta.
Elektrolyysi suoritetaan grafiittianodilla ja teräskatodilla. Syanidit tuhoutuvat sähkökemiallisen hapettumisen aikana ja kloori, joka vapautuu anodille. Tällaisen puhdistuksen tehokkuus on lähellä 100%.
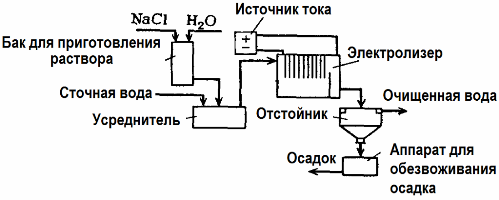
Suoran sähkökemiallisen puhdistuksen lisäksi se voidaan sisällyttää elektrolyysiprosessiin hyytyminen. Lukuun ottamatta suolojen lisäämistä, elektrolyysi suoritetaan liukoisilla alumiini- tai rauta-anodoilla. Sitten ei vain anodin epäpuhtaudet tuhoudu, vaan anodi itse liukenee. Muodostuu aktiivisia dispergoituneita yhdisteitä, jotka koaguloivat (sakeuttavat) kolloidisia dispergoituneita vieraita aineita.
Tämä menetelmä on tehokas puhdistamaan rasvojen, öljytuotteiden, väriaineiden, öljyjen, radioaktiivisten aineiden jne. Jätevettä. Sitä kutsutaan sähkökoagulaatioksi.
galvanointi
Galvanointi on tiettyjen metallien elektrolyyttinen laskeuma suojaamaan tuotteita korroosiolta ja antamaan niille sopiva esteettinen ulkonäkö (pinnoite tehdään kromilla, nikkelillä, hopealla, kullalla, platinalla jne.). Asia puhdistetaan perusteellisesti, rasvanpoistetaan ja käytetään katodina elektrolyyttisessä kylvyssä, johon kaadetaan metallin suolaliuos, jolla tuote on tarpeen päällystää.
Anodina käytetään saman metallin levyä. Yleensä käytetään paria anodilevyjä, ja sinkitty kohde asetetaan niiden väliin.
galvanoplastics
Galvanointi - metallin kerrostuminen eri kappaleiden pinnalle niiden muotojen toistamiseksi: muotit osien valuun, veistokset, painetut kliseet jne.

Metallin galvaaninen laskeuma esineen pinnalle on mahdollista vain, kun tämä pinta tai koko esine on sähkövirtajohdin, joten on suositeltavaa käyttää metalleja mallien tai muotojen valmistukseen. Sulavat metallit ovat sopivimpia tähän tarkoitukseen: lyijy, tina, juotteet, puuseos.
Nämä metallit ovat pehmeitä, helposti työstettäviä metallityökaluilla, ovat hyvin kaiverrettuja ja valettuja. Galvaanisen kerroksen rakentamisen ja viimeistelyn jälkeen muottimetalli sulatetaan lopputuotteesta.
Suurimpia mahdollisuuksia mallien valmistukseen edustavat kuitenkin dielektriset materiaalit. Tällaisten mallien metalloimiseksi on tarpeen antaa niiden pinnan sähkönjohtavuus. Menestys tai epäonnistuminen riippuu viime kädessä pääasiassa johtavan kerroksen laadusta. Tämä kerros voidaan levittää yhdellä kolmesta tapaa.
Yleisin tapa on grafitirovanie, se sopii muovailuvahamalleille ja muille materiaaleille, jotka mahdollistavat grafiitin jauhamisen pinnalle.
Seuraava temppu on veikkausta, menetelmä on hyvä malleille, joilla on suhteellisen monimutkainen muoto, erilaisille materiaaleille, mutta pronssikerroksen paksuuden vuoksi pienten yksityiskohtien siirto on jonkin verran vääristynyt.
Ja lopuksi hopeointisopii kaikissa tapauksissa, mutta on erityisen välttämätöntä herkille malleille, joilla on hyvin monimutkainen muoto - kasveille, hyönteisille jne.
Kemialliset virtalähteet
Elektrolyysi on myös pääprosessi, jonka vuoksi nykyaikaiset kemialliset virtalähteet, kuten paristot ja akut, toimivat. Elektrolyytin kanssa on kosketuksessa kaksi elektrodia.
Elektrodien välillä vahvistetaan potentiaaliero - sähkömoottorivoima, joka vastaa redox-reaktion vapaata energiaa. Katso tästä lisätietoja: Kemialliset sähkövirran lähteet
Sitruuna-akku (napsauta kuvaa suurentaaksesi)
Kemiallisten virtalähteiden toiminta perustuu alueellisesti erotettujen prosessien esiintymiseen suljetulla ulkoisella piirillä: negatiivisella anodilla pelkistin hapettuu, muodostuneet vapaat elektronit kulkevat ulkoisen piirin läpi positiiviseen katodiin, muodostaen purkausvirran, jossa ne osallistuvat hapettumisen pelkistysreaktioon. Siten negatiivisesti varautuneiden elektronien virtaus ulkoista virtapiiriä pitkin kulkee anodista katodiin, siis negatiivisesta elektrodista positiiviseen.
Katso myös osoitteesta bgv.electricianexp.com
: