Κατηγορίες: Προτεινόμενα άρθρα » Αρχάριοι ηλεκτρολόγοι
Αριθμός προβολών: 36288
Σχόλια σχετικά με το άρθρο: 1
Πηγές χημικού ρεύματος: κύρια χαρακτηριστικά
 Για περισσότερο από δύο αιώνες, η ανθρωπότητα χρησιμοποιεί την ενέργεια των χημικών αντιδράσεων μεταξύ διαφόρων ουσιών για την παραγωγή συνεχούς ρεύματος.
Για περισσότερο από δύο αιώνες, η ανθρωπότητα χρησιμοποιεί την ενέργεια των χημικών αντιδράσεων μεταξύ διαφόρων ουσιών για την παραγωγή συνεχούς ρεύματος.
Αρχή λειτουργίας
Η αντίδραση οξειδοαναγωγής που εμφανίζεται μεταξύ ουσιών με τις ιδιότητες ενός οξειδωτικού παράγοντα και ενός αναγωγικού παράγοντα συνοδεύεται από την απελευθέρωση ηλεκτρονίων, η κίνηση των οποίων σχηματίζει ηλεκτρικό ρεύμα. Ωστόσο, προκειμένου να χρησιμοποιηθεί η ενέργεια του, είναι απαραίτητο να δημιουργηθούν συνθήκες για τη διέλευση ηλεκτρονίων μέσω ενός εξωτερικού κυκλώματος, διαφορετικά απελευθερώνεται με θερμότητα από απλό μίγμα οξειδωτικού παράγοντα και αναγωγικού παράγοντα.
Επομένως, όλες οι πηγές χημικού ρεύματος έχουν δύο ηλεκτρόδια:
-
η άνοδος στην οποία λαμβάνει χώρα η οξείδωση.
-
καθόδου, πραγματοποιώντας την αποκατάσταση της ουσίας.
Ηλεκτρόδια σε απόσταση τοποθετούνται σε ένα δοχείο με έναν ηλεκτρολύτη - μια ουσία που διεξάγει ηλεκτρικό ρεύμα λόγω των διαδικασιών διαχωρισμού του μέσου σε ιόντα.
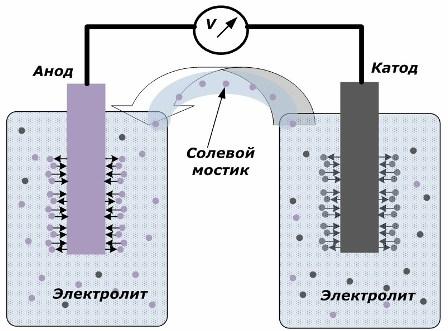
Η αρχή της μετατροπής της χημικής ενέργειας σε ηλεκτρική ενέργεια
Το σχήμα δείχνει ότι τα ηλεκτρόδια τοποθετούνται σε χωριστά δοχεία συνδεδεμένα με μια γέφυρα αλατιού μέσω της οποίας δημιουργείται η κίνηση ιόντων κατά μήκος του εσωτερικού κυκλώματος. Όταν τα εξωτερικά και τα εσωτερικά κυκλώματα είναι ανοικτά, διεξάγονται δύο διαδικασίες στα ηλεκτρόδια: η μετάβαση των ιόντων από το μέταλλο του ηλεκτροδίου στον ηλεκτρολύτη και η μετάβαση των ιόντων από τον ηλεκτρολύτη στο κρυσταλλικό πλέγμα των ηλεκτροδίων.
Οι ρυθμοί ροής αυτών των διαδικασιών είναι ίδιοι και τα δυναμικά τάσης των αντίθετων σημείων συσσωρεύονται σε κάθε ηλεκτρόδιο. Εάν συνδέονται μέσω γέφυρας αλατιού και εφαρμόζεται φορτίο, θα υπάρξει ηλεκτρικό κύκλωμα. Ένα εσωτερικό ρεύμα παράγεται από την κίνηση των ιόντων μεταξύ των ηλεκτροδίων μέσω του ηλεκτρολύτη και της γέφυρας του άλατος. Η κίνηση των ηλεκτρονίων κατά μήκος του εξωτερικού κυκλώματος από την άνοδο στην κάθοδο συμβαίνει.
Σχεδόν όλες οι αντιδράσεις οξειδοαναγωγής συνοδεύονται από ηλεκτροπαραγωγή. Αλλά η αξία του εξαρτάται από πολλούς παράγοντες, συμπεριλαμβανομένων των όγκων και των μαζών των χρησιμοποιούμενων χημικών ουσιών, των υλικών που χρησιμοποιούνται για την κατασκευή των ηλεκτροδίων, όπως του ηλεκτρολύτη, της συγκέντρωσης ιόντων, του σχεδιασμού.
Η πιο ευρέως χρησιμοποιούμενη στις σύγχρονες πηγές χημικού ρεύματος είναι:
-
για το υλικό της ανόδου (αναγωγικός παράγοντας), ψευδάργυρος (Zn), μόλυβδος (Pb), κάδμιο (Cd) και μερικά άλλα μέταλλα.
-
για το υλικό καθόδου (οξειδωτικό) - οξείδιο του μολύβδου PbO2, οξείδιο του μαγγανίου MnO2, υδροξείδιο του νικελίου NiOOH και άλλα,
-
ηλεκτρολύτες με βάση διαλύματα οξέων, αλκαλίων ή αλάτων.
Μέθοδοι ταξινόμησης
Ένα μέρος των πηγών χημικής ενέργειας μπορεί να επαναχρησιμοποιηθεί, ενώ το άλλο δεν μπορεί. Η αρχή αυτή λαμβάνεται ως βάση για την ταξινόμησή τους.
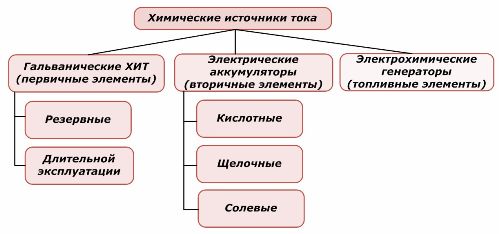
Ταξινόμηση των χημικών στοιχείων
Ηλεκτροκινητική δύναμη γαλβανικά κύτταρα, ανάλογα με το σχεδιασμό, φτάνει στα 1,2 ÷ 1,5 volts. Για τη λήψη μεγάλων τιμών, συνδυάζονται σε μπαταρίες, συνδέοντας σε σειρά. Όταν οι μπαταρίες είναι συνδεδεμένες παράλληλα, αυξάνεται το ρεύμα και η ισχύς.
Είναι γενικά αποδεκτό ότι οι πρωτογενείς πηγές χημικού ρεύματος δεν υποστηρίζουν την επαναφόρτιση, αν και πιο συγκεκριμένα αυτή η θέση μπορεί να διατυπωθεί διαφορετικά: η υλοποίησή της δεν είναι οικονομικά εφικτή.
Οι πλεονασματικές πρωτογενείς πηγές χημικού ρεύματος αποθηκεύονται σε κατάσταση όπου ο ηλεκτρολύτης απομονώνεται από τα ηλεκτρόδια. Αυτό εξαλείφει την εμφάνιση της οξειδοαναγωγικής αντίδρασης και εξασφαλίζει την ετοιμότητα για την έναρξη λειτουργίας. Δεν επαναχρησιμοποιούνται. Η διάρκεια ζωής των χημικών πηγών εφεδρικής ισχύος περιορίζεται σε 10-15 χρόνια.
Οι μπαταρίες επαναφορτίζονται με επιτυχία με την εφαρμογή εξωτερικής ηλεκτρικής ενέργειας. Λόγω αυτής της δυνατότητας, ονομάζονται δευτερεύουσες πηγές ρεύματος. Είναι σε θέση να αντέχουν σε εκατοντάδες και χιλιάδες κύκλους φόρτισης-απόρριψης.Το EMF της μπαταρίας μπορεί να κυμαίνεται από 1,0 ÷ 1,5 volt. Συντίθενται επίσης σε μπαταρίες.
Οι ηλεκτροχημικές γεννήτριες λειτουργούν με βάση την αρχή των γαλβανικών κυψελών, αλλά μεταφέρουν ουσίες από το εξωτερικό για να διεξάγουν ηλεκτροχημική αντίδραση και όλα τα απελευθερωμένα προϊόντα αφαιρούνται από τον ηλεκτρολύτη. Αυτό σας επιτρέπει να οργανώσετε μια συνεχή διαδικασία.
Κύρια χαρακτηριστικά απόδοσης των πηγών χημικής ενέργειας
1. Η τάση στους ανοικτούς ακροδέκτες
Ανάλογα με το σχεδιασμό, μια μόνο πηγή μπορεί να δημιουργήσει μόνο μια συγκεκριμένη διαφορά δυναμικού. Για χρήση σε ηλεκτρικές συσκευές, συνδυάζονται σε μπαταρίες.
2. Ειδική χωρητικότητα
Για ορισμένο χρόνο (σε ώρες) μία πηγή χημικού ρεύματος μπορεί να παράγει μια περιορισμένη ποσότητα ρεύματος (σε αμπέρ), η οποία αποδίδεται σε μια μονάδα βάρους ή όγκου.
3. Πυκνότητα ισχύος
Χαρακτηρίζει την ικανότητα μιας μονάδας βάρους ή όγκου μιας πηγής χημικού ρεύματος να παράγει ενέργεια που παράγεται από το προϊόν της τάσης από την ισχύ του ρεύματος.
4. Διάρκεια λειτουργίας
Αυτή η παράμετρος ονομάζεται επίσης ημερομηνία λήξης.
5. Η τιμή των ρευμάτων αυτοαποφόρτισης
Αυτές οι πλευρικές διεργασίες των ηλεκτροχημικών αντιδράσεων οδηγούν στην κατανάλωση της ενεργού μάζας των στοιχείων, προκαλούν τη διάβρωση και μειώνουν τη συγκεκριμένη ικανότητα.
6. Τιμή προϊόντος
Εξαρτάται από το σχεδιασμό, τα υλικά που χρησιμοποιούνται και από πολλούς άλλους παράγοντες.
Οι καλύτερες πηγές χημικού ρεύματος είναι εκείνες με υψηλές τιμές των πρώτων τεσσάρων παραμέτρων και η αυτοεκφόρτιση και το κόστος είναι χαμηλές.
Αρχές φόρτισης μπαταρίας
Μεταξύ των δευτερογενών πηγών χημικού ρεύματος, κερδίζουν μεγάλη δημοτικότητα. μοντέλα ιόντων λιθίου, τα οποία έχουν γίνει ευρέως χρησιμοποιούμενα για την τροφοδοσία ηλεκτρονικών συσκευών. Χρησιμοποιούν LiMO2 (M Co, Ni, Mn) ως υλικό του θετικού ηλεκτροδίου και γραφίτη ως το αρνητικό ηλεκτρόδιο.
Όταν φορτιστούν, τα ιόντα λιθίου από την εφαρμοζόμενη εξωτερική ενέργεια απελευθερώνονται από το μέταλλο της καθόδου, διέρχονται μέσω του ηλεκτρολύτη και διεισδύουν στο χώρο μεταξύ των στρώσεων γραφίτη, συσσωρεύονται εκεί.
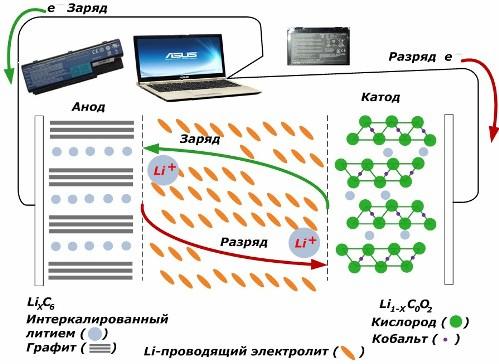
Όταν η ενέργεια φορτιστή απουσιάζει και το φορτίο συνδέεται με τα ηλεκτρόδια, τότε τα ιόντα λιθίου στον ηλεκτρολύτη κινούνται προς την αντίθετη κατεύθυνση.
Εάν η φόρτιση και η εκφόρτιση δεν εκτελούνται, τότε η ενέργεια στην μπαταρία δεν καταναλώνεται, αλλά αποθηκεύεται. Αλλά η ποσότητα του περιορίζεται από τις ιδιότητες των χρησιμοποιούμενων υλικών. Για παράδειγμα, στις μπαταρίες ιόντων λιθίου, η συγκεκριμένη ηλεκτρική χωρητικότητα είναι 130 ÷ 150 mAh / g. Περιορίζεται από τις ιδιότητες του υλικού ανόδου. Για το γραφίτη, η χωρητικότητα είναι περίπου δύο φορές υψηλότερη.
Οι επιστήμονες αναζητούν τώρα τρόπους αύξησης της χωρητικότητας της μπαταρίας, διερευνούν τη δυνατότητα χρήσης χημικής αντίδρασης μεταξύ λιθίου και οξυγόνου στον αέρα. Για να γίνει αυτό, τα σχέδια αναπτύσσονται με μια μη αναλώσιμη καθόδου αέρα, που χρησιμοποιείται σε ξεχωριστές μπαταρίες. Αυτή η μέθοδος μπορεί να αυξήσει την πυκνότητα ενέργειας έως και 10 φορές.
Η λειτουργία πηγών χημικού ρεύματος απαιτεί γνώση βασικές αρχές της ηλεκτρολογίας, ηλεκτροχημεία, επιστήμη υλικών και φυσική στερεάς κατάστασης.
Δείτε επίσης στο i.electricianexp.com
:
