Κατηγορίες: Προτεινόμενα άρθρα » Αρχάριοι ηλεκτρολόγοι
Αριθμός προβολών: 70526
Σχόλια σχετικά με το άρθρο: 0
Γαλβανικά κύτταρα - συσκευή, αρχή λειτουργίας, τύποι και κύρια χαρακτηριστικά
Προϋποθέσεις για την εμφάνιση γαλβανικών κυττάρων. Λίγη ιστορία. Το 1786, ο Ιταλός καθηγητής της ιατρικής, ο φυσιολόγος Luigi Aloisio Galvani, ανακάλυψε ένα ενδιαφέρον φαινόμενο: οι μύες των οπίσθιων ποδιών ενός νεοσύστατου πτώματος ενός βάτραχου που αιωρούνται σε άγκιστρα χαλκού συστέλλονταν όταν ο επιστήμονας τους αγγίξει με ένα νυστέρι χάλυβα. Ο Γκάλβανι κατέληξε αμέσως στο συμπέρασμα ότι αυτή ήταν μια εκδήλωση "ηλεκτρικής ενέργειας των ζώων".
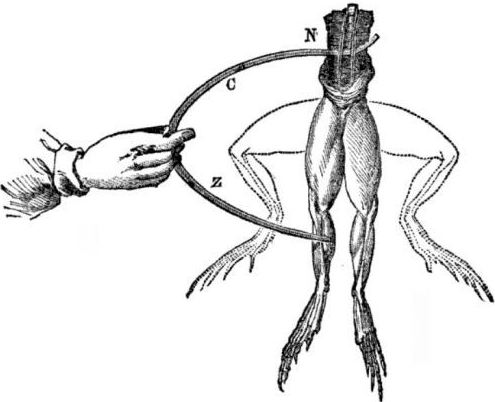
Μετά το θάνατο του Γκάλβανι, ο σύγχρονος Alessandro Volta, ως χημικός και φυσικός, θα περιγράψει και θα παρουσιάσει δημοσίως έναν πιο ρεαλιστικό μηχανισμό για την εμφάνιση ηλεκτρικού ρεύματος όταν έρθουν σε επαφή διάφορα μέταλλα.
Η Volta, μετά από μια σειρά πειραμάτων, θα καταλήξει στο μονοσήμαντο συμπέρασμα ότι το ρεύμα εμφανίζεται στο κύκλωμα λόγω της παρουσίας δύο αγωγών διαφορετικών μετάλλων τοποθετημένων σε ένα υγρό και αυτό δεν είναι καθόλου "ζωική ηλεκτρική ενέργεια", όπως σκέφτηκε ο Galvani. Η συστροφή των ποδιών των βατράχων ήταν συνέπεια της δράσης του ρεύματος που προήλθε από την επαφή διαφόρων μετάλλων (αγκίστρια χαλκού και ένα νυστέρι χάλυβα).
Το Volta θα παρουσιάσει τα ίδια φαινόμενα που έδειξε ο Γκάλβαν σε νεκρό βάτραχο, αλλά σε ένα εντελώς άψυχο οικιακό ηλεκτρόμετρο και το 1800 θα δώσει μια ακριβή εξήγηση για το ρεύμα: «ο αγωγός δεύτερης κατηγορίας (υγρό) είναι στη μέση και έρχεται σε επαφή με δύο αγωγούς πρώτης τάξης δύο διαφορετικών μέταλλα ... Ως αποτέλεσμα αυτού προκύπτει ένα ηλεκτρικό ρεύμα μιας κατεύθυνσης. "

Σε ένα από τα πρώτα πειράματα, ο Βόλτα μείωσε δύο πλάκες - ψευδάργυρο και χαλκό - σε ένα βάζο με οξύ και τις συνέδεσε με σύρμα. Μετά από αυτό, η πλάκα ψευδαργύρου άρχισε να διαλύεται και φυσαλίδες αερίου σχηματίζονται στον χαλκό. Ο Βόλτα πρότεινε και απέδειξε ότι ρέει ηλεκτρικό ρεύμα μέσω του σύρματος.
Έτσι εφευρέθηκε το "στοιχείο Volta" - το πρώτο γαλβανικό κελί. Για λόγους ευκολίας, η Volta έδωσε το σχήμα ενός κάθετου κυλίνδρου (στύλου), που αποτελείται από διασυνδεδεμένους δακτυλίους ψευδαργύρου, χαλκού και υφάσματος εμποτισμένου με οξύ. Ένας πόλος βολτ μισό μέτρο ύψος δημιούργησε μια τάση ευαίσθητη στους ανθρώπους.
Από την αρχή της έρευνας βγήκε ο Luigi Galvani, το όνομα χημική πηγή ρεύματος διατήρησε τη μνήμη του στο όνομά του.
Γαλβανική κυψέλη Είναι μια χημική πηγή ηλεκτρικού ρεύματος, με βάση την αλληλεπίδραση δύο μετάλλων και / ή των οξειδίων τους σε έναν ηλεκτρολύτη, που οδηγεί στην εμφάνιση ενός ηλεκτρικού ρεύματος σε κλειστό κύκλωμα. Έτσι, στα γαλβανικά κύτταρα, η χημική ενέργεια μετατρέπεται σε ηλεκτρική ενέργεια.
Κύτταρα σήμερα

Τα κύτταρα σήμερα ονομάζονται μπαταρίες. Τρία είδη μπαταριών είναι ευρέως διαδεδομένα: αλατούχο (ξηρό), αλκαλικό (ονομάζονται επίσης αλκαλικά, "αλκαλικά" σε μετάφραση από τα αγγλικά - "αλκαλικά") και το λίθιο. Η αρχή της δουλειάς τους είναι η ίδια με αυτή που περιγράφεται από τη Βόλτα το 1800: δύο μέταλλα αλληλεπιδρούν μέσω του ηλεκτρολύτη, και ένα ηλεκτρικό ρεύμα εμφανίζεται σε ένα εξωτερικό κλειστό κύκλωμα.
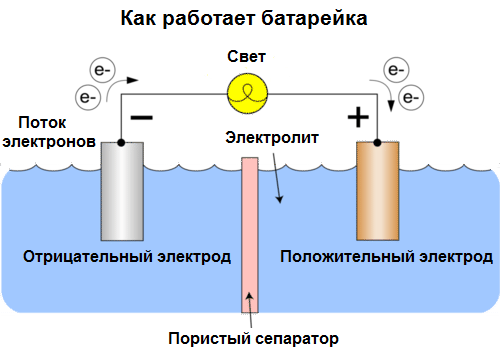
Η τάση της μπαταρίας εξαρτάται από τα χρησιμοποιούμενα μέταλλα και από τον αριθμό των κυψελών της μπαταρίας. Οι μπαταρίες, σε αντίθεση με τις μπαταρίες, δεν είναι σε θέση να αποκαταστήσουν τις ιδιότητές τους, αφού μετατρέπουν άμεσα τη χημική ενέργεια, δηλαδή την ενέργεια των αντιδραστηρίων (αναγωγικό και οξειδωτικό) που συνθέτουν την μπαταρία σε ηλεκτρική ενέργεια.
Τα αντιδραστήρια που περιλαμβάνονται στην μπαταρία καταναλώνονται κατά τη διάρκεια της λειτουργίας του, το ρεύμα μειώνεται βαθμιαία, έτσι η δράση της πηγής τελειώνει αφού τα αντιδραστήρια αντιδράσουν πλήρως.
Τα αλκαλικά και τα στοιχεία αλατιού (μπαταρίες) χρησιμοποιούνται ευρέως για την τροφοδοσία ποικίλων ηλεκτρονικών συσκευών, ραδιοεξοπλισμού, παιχνιδιών και λιθίου, τα οποία απαντώνται συχνότερα σε φορητές ιατρικές συσκευές, όπως μετρητές γλυκόζης αίματος ή σε ψηφιακή τεχνολογία, όπως κάμερες.

Αλάτι μπαταρίες
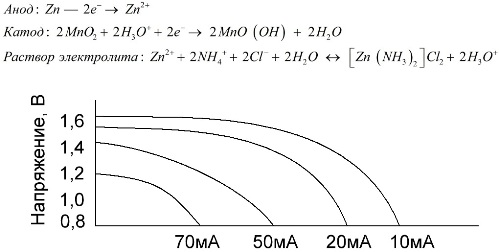
Τα κύτταρα μαγγανίου-ψευδαργύρου, που ονομάζονται μπαταρίες αλατιού, είναι "ξηρά" γαλβανικά κύτταρα, εντός των οποίων δεν υπάρχει υγρό διάλυμα ηλεκτρολύτη.
Ένα ηλεκτρόδιο ψευδαργύρου (+) είναι μια κάθοδος σε σχήμα κυπέλλου και ένα σκόνη μείγμα διοξειδίου του μαγγανίου και γραφίτη χρησιμεύει ως άνοδος. Το ρεύμα ρέει μέσω ράβδου γραφίτη. Ως ηλεκτρολύτης, μια πάστα χρησιμοποιείται από ένα διάλυμα χλωριούχου αμμωνίου με την προσθήκη αμύλου ή αλεύρου για να πυκνώσει, ώστε να μη ρέει τίποτα.
Συνήθως, οι κατασκευαστές μπαταριών δεν δείχνουν την ακριβή σύνθεση των στοιχείων αλατιού, ωστόσο οι μπαταρίες αλατιού είναι οι φθηνότερες, χρησιμοποιούνται συνήθως σε συσκευές όπου η κατανάλωση ενέργειας είναι εξαιρετικά χαμηλή: σε ώρες, σε τηλεχειριστήρια, σε ηλεκτρονικά θερμόμετρα κ.λπ.

Η έννοια της "ονομαστικής χωρητικότητας" χρησιμοποιείται σπάνια για τον χαρακτηρισμό των μπαταριών μαγγανίου-ψευδαργύρου, δεδομένου ότι η χωρητικότητά τους εξαρτάται σε μεγάλο βαθμό από τις συνθήκες και τις συνθήκες λειτουργίας. Τα κύρια μειονεκτήματα αυτών των στοιχείων είναι ο σημαντικός ρυθμός μείωσης της τάσης καθ 'όλη τη διάρκεια της εκφόρτισης και η σημαντική μείωση της χωρητικότητας εξόδου με την αύξηση του ρεύματος εκκένωσης. Η τελική τάση εκφόρτισης ρυθμίζεται ανάλογα με το φορτίο στην περιοχή από 0,7-1,0 V.
Είναι σημαντικό όχι μόνο το μέγεθος του ρεύματος εκκένωσης, αλλά και το χρονοδιάγραμμα του φορτίου. Με διαλείπουσες εκφορτίσεις μεγάλων και μεσαίων ρευμάτων, η απόδοση των μπαταριών αυξάνεται σημαντικά σε σύγκριση με τη συνεχή λειτουργία. Ωστόσο, με μικρά ρεύματα εκφόρτισης και μήνες διακοπής λειτουργίας, η χωρητικότητά τους μπορεί να μειωθεί ως αποτέλεσμα της αυτοεκφόρτισης.
Το παραπάνω γράφημα δείχνει τις καμπύλες απόρριψης για μια μέση μπαταρία αλατιού για 4, 10, 20 και 40 ώρες για σύγκριση με μια αλκαλική μπαταρία, η οποία θα συζητηθεί αργότερα.
Αλκαλικές (αλκαλικές) μπαταρίες
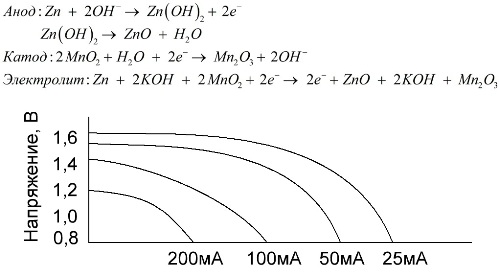
Μια αλκαλική μπαταρία είναι μια γαλβανική μπαταρία μαγγανίου-ψευδαργύρου, στην οποία το διοξείδιο του μαγγανίου χρησιμοποιείται ως κάθοδος, ο ψευδάργυρος σε σκόνη χρησιμοποιείται ως άνοδος και ένα αλκαλικό διάλυμα χρησιμοποιείται ως ηλεκτρολύτης, συνήθως με τη μορφή πάστατος υδροξειδίου του καλίου.
Αυτές οι μπαταρίες έχουν ορισμένα πλεονεκτήματα (συγκεκριμένα, σημαντικά μεγαλύτερη χωρητικότητα, καλύτερη απόδοση σε χαμηλές θερμοκρασίες και ρεύματα υψηλού φορτίου).

Οι αλκαλικές μπαταρίες, σε σύγκριση με τις αλατιού, μπορούν να παράσχουν περισσότερο ρεύμα για μεγάλο χρονικό διάστημα. Ένα μεγαλύτερο ρεύμα καθίσταται εφικτό επειδή ο ψευδάργυρος δεν χρησιμοποιείται εδώ με τη μορφή γυαλιού, αλλά με τη μορφή σκόνης που έχει μεγαλύτερη επιφάνεια επαφής με τον ηλεκτρολύτη. Το υδροξείδιο του καλίου με τη μορφή πάστας χρησιμοποιείται ως ηλεκτρολύτης.
Χάρη στην ικανότητα αυτού του τύπου γαλβανικών κυψελών να παράσχουν ένα σημαντικό ρεύμα (έως 1Α) για μεγάλο χρονικό διάστημα, οι αλκαλικές μπαταρίες είναι συνηθέστερες σήμερα.
Σε ηλεκτρικά παιχνίδια, σε φορητό ιατρικό εξοπλισμό, σε ηλεκτρονικές συσκευές, σε κάμερες, χρησιμοποιούνται αλκαλικές μπαταρίες παντού. Εξυπηρετούν 1,5 φορές περισσότερο από το φυσιολογικό ορό, αν η εκφόρτιση είναι χαμηλή. Το γράφημα δείχνει τις καμπύλες εκφόρτισης σε διαφορετικά ρεύματα για σύγκριση με μπαταρία αλατιού (το γράφημα δόθηκε παραπάνω) για 4, 10, 20 και 40 ώρες.
Μπαταρίες λιθίου
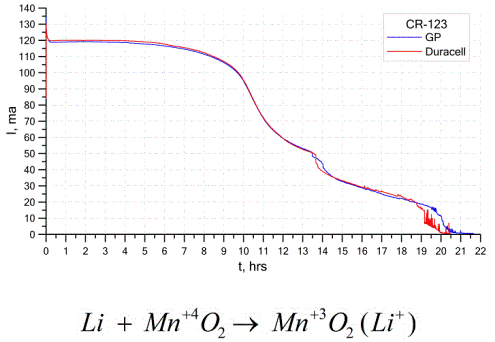
Ένας άλλος αρκετά συνηθισμένος τύπος γαλβανικών κυψελών είναι οι μπαταρίες λιθίου - απλά μη επαναφορτιζόμενα γαλβανικά κύτταρα στα οποία το λίθιο ή οι ενώσεις του χρησιμοποιούνται ως άνοδος. Λόγω της χρήσης αλκαλικών μετάλλων, έχουν μεγάλη διαφορά δυναμικού.

Η κάθοδος και ο ηλεκτρολύτης ενός κυττάρου λιθίου μπορεί να είναι πολύ διαφορετικοί, οπότε ο όρος "κύτταρο λιθίου" συνδυάζει μια ομάδα κυττάρων με το ίδιο υλικό ανόδου.Ως κάθοδος, για παράδειγμα, μπορεί να χρησιμοποιηθεί διοξείδιο μαγγανίου, μονοφθοριούχο άνθρακα, πυρίτης, θειονυλοχλωρίδιο κλπ.
Οι μπαταρίες λιθίου διακρίνονται από τις άλλες μπαταρίες λόγω του υψηλού χρόνου εκτέλεσης και του υψηλού κόστους. Ανάλογα με το επιλεγμένο μέγεθος και τα χρησιμοποιούμενα χημικά υλικά, μια μπαταρία λιθίου μπορεί να παράγει τάσεις από 1,5 V (συμβατές με αλκαλικές μπαταρίες) έως 3,7 V.
Αυτές οι μπαταρίες έχουν την υψηλότερη χωρητικότητα ανά μονάδα μάζας και μεγάλη διάρκεια ζωής. Τα κύτταρα λιθίου χρησιμοποιούνται ευρέως στον σύγχρονο φορητό ηλεκτρονικό εξοπλισμό: για την τροφοδοσία ρολογιών στις μητρικές υπολογιστές, για την τροφοδοσία φορητών ιατρικών συσκευών, ρολογιών, αριθμομηχανών, φωτογραφικού εξοπλισμού κλπ.
Το παραπάνω γράφημα δείχνει τις καμπύλες απόρριψης για δύο μπαταρίες λιθίου από δύο δημοφιλείς κατασκευαστές. Το αρχικό ρεύμα ήταν 120 mA (ανά αντίσταση της τάξεως των 24 Ohms).
Δείτε επίσης: Μοντέρνες επαναφορτιζόμενες μπαταρίες - πλεονεκτήματα και μειονεκτήματα
Δείτε επίσης στο i.electricianexp.com
: