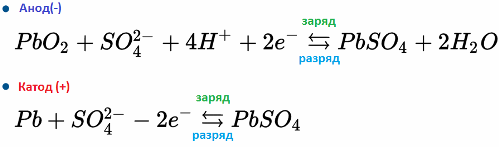Kategorie: Jak to funguje, Auto elektrikář
Počet zobrazení: 16526
Komentáře k článku: 0
Zařízení a princip provozu na baterie
Elektrická baterie se nazývá opakovaně použitelný zdroj chemického proudu. Chemické procesy uvnitř baterie, na rozdíl od procesů v jednorázových galvanických článcích, jako jsou alkalické nebo solné baterie, jsou reverzibilní. Cykly vybíjení, akumulace a návratu elektrické energie se mohou mnohokrát opakovat.
Princip fungování baterie vám tedy umožňuje cyklicky ji používat pro autonomní napájení různých zařízení, přenosných zařízení, vozidel, lékařského vybavení atd. Ve zcela odlišných oblastech.

Mluvíme-li slovo „baterie“, míní to buď samotnou baterii, nebo bateriový článek. Baterii tvoří několik sérií nebo paralelně propojených bateriových článků a několik připojených baterií.
První baterie, tj. Opakovaně použitelný galvanický článek, se objevila podle oficiálních údajů v roce 1803. Vytvořil jej německý fyzik a chemik Johann Wilhelm Ritter. Kamarád Oersted, Ritter, který nebyl vědcem, studoval chemický účinek světla, experimentoval s elektrolýzou, mimochodem patří k objevu ultrafialové části elektromagnetického spektra.
Zatímco experimentoval s voltaic sloupcem, Ritter vzal padesát kruhů mědi, kousky mokré látky a vytvořil sloupec padesáti takových kruhů a mokré látky mezi nimi. Ritter, který prošel proudem ze sopického sloupce strukturou, zjistil, že jeho pól byl nabitý a sám se stal zdrojem elektřiny. To byla první baterie.
Reverzibilita chemické reakce v elektrolytu a na elektrodách baterie vám umožňuje obnovit účinnost baterie - nabijte ji po vybití. Proud během nabíjení prochází baterií v opačném směru, než je vybíjení.
Například olověná baterie funguje v důsledku elektrochemických reakcí olova a oxidu olovnatého v kyselině sírové. Níže uvedené vzorce odrážejí reverzibilní reakce vyskytující se na anodě a na katodě: zleva doprava - reakce během výboje, zprava doleva - náboj.
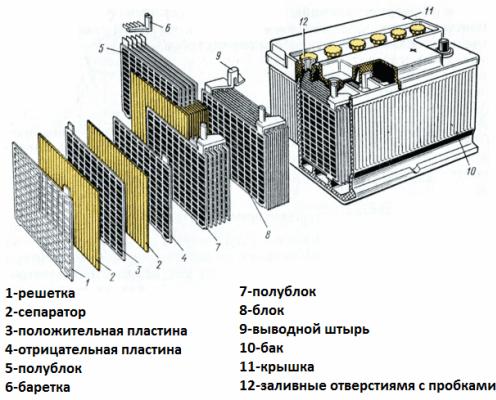
Nyní považujte bateriové zařízení za příklad startovací baterie automobilu. Jeho napětí je 12 voltů. Baterie se skládá ze šesti článků zapojených do série, oddělených oddíly.
Sériové připojení v tomto případě znamená, že záporný terminál jedné buňky je připojen k pozitivnímu terminálu další buňky.
Každý prvek obsahuje dvojici mřížkových elektrod slitiny olova a antimonu ponořených do elektrolytu, což je 38% vodný roztok kyseliny sírové. Porézní separátor izoluje elektrody od sebe, brání zkratům mezi nimi, ale volně prochází elektrolyt skrz sebe. To znamená, že kapalina vyplňuje jak buňky olověných desek, tak póry separátorů.
Desky stejného jména jsou vzájemně propojeny olověnými propojkami, jakož i balíčky desek oddělené oddíly, které tvoří jednotlivé prvky, a svorky baterie jsou rovněž vyrobeny z olova.
Závěry automobilové baterie se od sebe vždy mírně liší - kladný terminál má větší průměr než záporný, aby nedošlo k chybě při připojování.
Pouzdro na baterii je vyrobeno z dielektrického materiálu odolného vůči agresivnímu prostředí, teplotním extrémům a vibracím. Dnes jsou startovací pouzdra na baterie vyrobena z polypropylenu.
Pouzdro je hermeticky uzavřená nádoba s víkem, vybavená přírubami pro odolnou montáž.V pouzdrech starých baterií byly vždy umístěny zátky pro každý z galvanických článků tvořících baterii, takže v případě potřeby bylo možné přidat destilovanou vodu. Moderní bezúdržbové zástrčky baterií na pouzdrech nemají.
Další články o bateriích a jejich použití:
Jak jsou baterie pro solární elektrárny
Viz také na i.electricianexp.com
: