Kategorie: Vybrané články » Začátečníci elektrikáři
Počet zobrazení: 36288
Komentáře k článku: 1
Zdroje chemického proudu: hlavní charakteristiky
 Po více než dvě století lidstvo využívá energii chemických reakcí mezi různými látkami k výrobě stejnosměrného proudu.
Po více než dvě století lidstvo využívá energii chemických reakcí mezi různými látkami k výrobě stejnosměrného proudu.
Pracovní princip
Redoxní reakce, ke které dochází mezi látkami s vlastnostmi oxidačního činidla a redukčního činidla, je doprovázena uvolněním elektronů, jejichž pohyb vytváří elektrický proud. Aby se však využila jeho energie, je nutné vytvořit podmínky pro průchod elektronů vnějším obvodem, jinak se uvolňuje teplem z jednoduché směsi oxidačního činidla a redukčního činidla.
Proto všechny zdroje chemického proudu mají dvě elektrody:
-
anoda, na které dochází k oxidaci;
-
katoda, provádění obnovy látky.
Elektrody na dálku jsou umístěny v nádobě s elektrolytem - látkou, která vede elektrický proud v důsledku procesů disociace média na ionty.
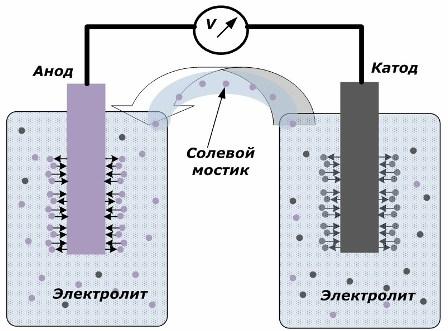
Princip přeměny chemické energie na elektrickou energii
Obrázek ukazuje, že elektrody jsou umístěny v oddělených nádobách spojených solným můstkem, kterým se vytváří pohyb iontů podél vnitřního obvodu. Když jsou vnější a vnitřní obvody otevřené, nastávají na elektrodách dva procesy: přechod iontů z kovu elektrody do elektrolytu a přechod iontů z elektrolytu do krystalové mřížky elektrod.
Průtokové rychlosti těchto procesů jsou stejné a na každé elektrodě se akumulují napěťové potenciály opačných znaků. Pokud jsou propojeny solným můstkem a působí zatížení, dojde k elektrickému obvodu. Vnitřní proud je generován pohybem iontů mezi elektrodami přes elektrolyt a solný můstek. Pohyb elektronů podél vnějšího obvodu ve směru od anody ke katodě.
Téměř všechny redoxní reakce jsou doprovázeny výrobou elektřiny. Jeho hodnota však závisí na mnoha faktorech, včetně objemu a hmotnosti použitých chemikálií, materiálů použitých k výrobě elektrod, jako je elektrolyt, koncentrace iontů, konstrukce.
Nejčastěji používané v moderních chemických zdrojích proudu jsou:
-
pro materiál anody (redukční činidlo), zinku (Zn), olova (Pb), kadmia (Cd) a některých dalších kovů;
-
pro katodový materiál (oxidační činidlo) - oxid olovnatý PbO2, oxid manganičitý MnO2, hydroxid niklu NiOOH a další;
-
elektrolyty na bázi roztoků kyselin, zásad nebo solí.
Klasifikační metody
Jedna část chemických zdrojů energie může být znovu použita, zatímco druhá nemůže. Tato zásada je brána jako základ pro jejich klasifikaci.
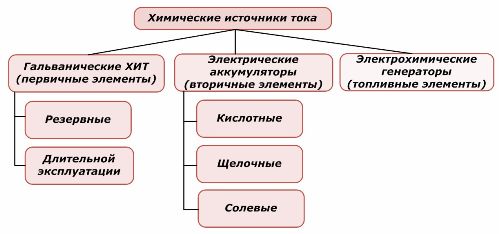
Klasifikace chemických prvků
Elektromotorická síla galvanické články, v závislosti na konstrukci, dosahuje 1,2 ÷ 1,5 V. Chcete-li získat velké hodnoty, jsou sloučeny do baterií a zapojeny do série. Pokud jsou baterie připojeny paralelně, zvyšuje se proud a energie.
Obecně se uznává, že primární chemické zdroje proudu nepodporují dobíjení, ačkoli přesněji lze tuto pozici formulovat odlišně: její implementace není ekonomicky proveditelná.
Redundantní zdroje primárního chemického proudu jsou uloženy ve stavu, kdy je elektrolyt izolován od elektrod. To eliminuje výskyt redoxní reakce a zajišťuje připravenost k uvedení do provozu. Nejsou znovu použity. Skladovatelnost chemických záložních zdrojů energie je omezena na 10–15 let.
Baterie jsou úspěšně dobíjeny aplikací externí elektrické energie. Díky této funkci se nazývají sekundární zdroje proudu. Jsou schopny vydržet stovky a tisíce cyklů vybíjení.EMF baterie může být v rozsahu 1,0 ÷ 1,5 V. Jsou také kombinovány do baterií.
Elektrochemické generátory pracují na principu galvanických článků, ale přenášejí látky zvenčí, aby provedly elektrochemickou reakci, a všechny uvolněné produkty jsou z elektrolytu odstraněny. To vám umožní uspořádat nepřetržitý proces.
Klíčové výkonové charakteristiky chemických zdrojů energie
1. Napětí přes otevřené svorky
V závislosti na designu může jediný zdroj vytvořit pouze určitý potenciální rozdíl. Pro použití v elektrických zařízeních jsou sloučeny do baterií.
2. Specifická kapacita
Po určitou dobu (v hodinách) může jeden zdroj elektrického proudu generovat omezené množství proudu (v ampérech), které je přiřazeno jednotce hmotnosti nebo objemu.
3. Výkonová hustota
Charakterizuje schopnost jednotky hmotnosti nebo objemu zdroje chemického proudu generovat energii generovanou součinem napětí podle síly proudu.
4. Doba provozu
Tento parametr se také nazývá datum vypršení platnosti.
5. Hodnota samonabíjecích proudů
Tyto vedlejší procesy elektrochemických reakcí vedou ke spotřebě aktivní hmoty prvků, způsobují korozi a snižují měrnou kapacitu.
6. Cena produktu
Závisí na designu, použitých materiálech a řadě dalších faktorů.
Nejlepší zdroje proudu chemikálií jsou zdroje s vysokými hodnotami prvních čtyř parametrů a samovybíjení a náklady jsou nízké.
Zásady nabíjení baterie
Mezi sekundárními zdroji chemického proudu získávají velkou popularitu. lithium-iontové modely, které se široce používají k napájení elektronických zařízení. Jako materiál kladné elektrody používají LiMO2 (M Co, Ni, Mn) a jako negativní grafit.
Při nabíjení se lithiové ionty z aplikované vnější energie uvolňují z katodového kovu, procházejí elektrolytem a pronikají do prostoru mezi grafitovými vrstvami, kde se hromadí.
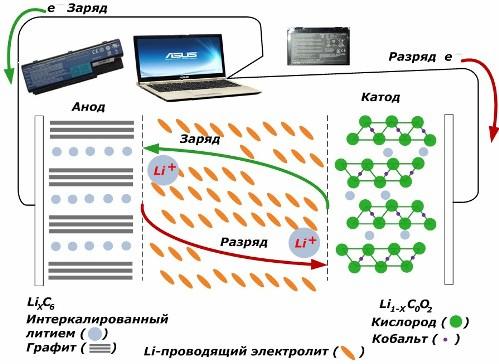
Když energie nabíječka je nepřítomen a zátěž je připojena k elektrodám, potom se lithiové ionty v elektrolytu pohybují opačným směrem.
Pokud nabíjení a vybití nejsou prováděny, energie v baterii není spotřebována, ale uložena. Jeho množství je však omezeno vlastnostmi použitých materiálů. Například v lithium-iontových bateriích je měrná elektrická kapacita 130 × 150 mAh / g. Je omezena vlastnostmi anodového materiálu. U grafitu je kapacita asi dvakrát vyšší.
Vědci nyní hledají způsoby, jak zvýšit kapacitu baterie, zkoumají možnost použití chemické reakce mezi lithiem a kyslíkem ve vzduchu. Za tímto účelem jsou konstrukce vyvíjeny se vzduchovou, nespotřebitelnou katodou, která se používá v samostatných bateriích. Tato metoda může zvýšit hustotu energie až 10krát.
Provoz chemických zdrojů proudu vyžaduje znalosti základy elektrotechniky, elektrochemie, věda o materiálech a fyzika pevných látek.
Viz také na i.electricianexp.com
:
