categorii: Articole prezentate » Electricieni novici
Numar de vizualizari: 52646
Comentarii la articol: 4
Tranzistori. Partea 2. Conductori, izolatori și semiconductori
Începutul articolului: Istoric tranzistor, Tranzistoare: scop, dispozitiv și principii de funcționare
 În inginerie electrică, sunt utilizate diverse materiale. Proprietățile electrice ale substanțelor sunt determinate de numărul de electroni din orbita valenței exterioare. Cu cât sunt mai puțini electroni pe această orbită, cu cât sunt mai slabi asociați cu nucleul, cu atât mai ușor pot merge în deplasare.
În inginerie electrică, sunt utilizate diverse materiale. Proprietățile electrice ale substanțelor sunt determinate de numărul de electroni din orbita valenței exterioare. Cu cât sunt mai puțini electroni pe această orbită, cu cât sunt mai slabi asociați cu nucleul, cu atât mai ușor pot merge în deplasare.
Sub influența fluctuațiilor de temperatură, electronii se desprind de atom și se deplasează în spațiul interatomic. Astfel de electroni sunt numiți liberi și creează un curent electric în conductoare. Există un spațiu mare interatomic, există spații pentru electroni liberi să călătorească în materie?
Structura solidelor și a lichidelor pare continuă și densă, reminiscentă în structura unei bile de fir. Dar, de fapt, chiar și solidele seamănă mai mult cu o plasă de pescuit sau de volei. Desigur, acest lucru nu poate fi discernut la nivelul gospodăriei, dar prin studii științifice exacte s-a stabilit că distanțele dintre electroni și nucleul de atomi sunt mult mai mari decât dimensiunile proprii.
Dacă dimensiunea nucleului atomic este reprezentată sub forma unei bile dimensiunea unei mingi de fotbal, atunci electronii din acest model vor fi de dimensiunea unei mazăre, iar fiecare astfel de mazăre este situat din „miezul” la o distanță de câteva sute și chiar mii de metri. Iar între nucleu și electron este goliciunea - pur și simplu nu există nimic! Dacă ne imaginăm distanțele dintre atomii materiei pe aceeași scară, dimensiunile se vor dovedi a fi fantastic la toate - zeci și sute de kilometri!
Conductori buni de electricitate sunt metale. De exemplu, atomii de aur și argint au un singur electron în orbita exterioară, prin urmare sunt cei mai buni conductori. De asemenea, fierul conduce electricitate, dar ceva mai rău.
Conduceți energia electrică și mai rău aliaje de înaltă rezistență. Acestea sunt nichrom, manganin, constantan, fechral și altele. O astfel de varietate de aliaje de înaltă rezistență se datorează faptului că sunt concepute pentru a rezolva diverse probleme: elemente de încălzire, manometre, rezistențe de referință pentru instrumente de măsurare și multe altele.
Pentru a evalua capacitatea unui material de a conduce electricitate, conceptul de "Conductivitate electrică". Valoarea returnării este rezistivitate. În mecanică, aceste concepte corespund gravitației specifice.
izolatorispre deosebire de conductoare, nu sunt înclinați să piardă electroni. În ele, legătura electronului cu nucleul este foarte puternică și nu există aproape electroni liberi. Mai exact, dar foarte puțini. În același timp, în unele izolatoare există mai multe, iar calitatea lor de izolare este, în consecință, mai proastă. Este suficient să compari, de exemplu, ceramica și hârtia. Prin urmare, izolatorii pot fi împărțiți condiționat în buni și răi.
Apariția încărcărilor libere chiar și în izolatori se datorează vibrațiilor termice ale electronilor: sub influența temperaturii ridicate, proprietățile izolatoare se deteriorează, unii electroni reușesc încă să se desprindă de nucleu.
În mod similar, rezistivitatea unui conductor ideal ar fi zero. Dar, din fericire, nu există un astfel de conductor: imaginează-ți cum ar arăta legea lui Ohm ((I = U / R) cu zero în numitor !!! Adio la matematică și inginerie electrică.
Și numai la o temperatură zero absolută (-273,2 ° C), fluctuațiile termice se opresc complet, iar cel mai rău izolator devine suficient de bun. Pentru a determina numeric „acest lucru” este rău - folosiți conceptul de rezistivitate. Aceasta este rezistența în ohmi a unui cub cu o lungime a muchiei de 1 cm, dimensiunea rezistivității este obținută în ohmi / cm. Rezistența specifică a unor substanțe este prezentată mai jos.Conductivitatea este reciproca rezistivității, este unitatea de măsură a lui Siemens, - 1Sm = 1 / Ohm.
Au o conductivitate bună sau o rezistivitate scăzută: argint 1,5 * 10 ^ (- 6), citiți cum (unu și jumătate până la zece la puterea minus șase), cupru 1,78 * 10 ^ (- 6), aluminiu 2,8 * 10 ^ (- 6). Conductivitatea aliajelor cu rezistență ridicată este mult mai rea: constantan 0,5 * 10 ^ (- 4), nichrom 1,1 * 10 ^ (- 4). Aceste aliaje pot fi numite conductoare proaste. După toate aceste numere complexe, înlocuiți Ohm / cm.
Mai mult, semiconductorii se pot distinge ca o grupă separată: germaniu 60 Ohm / cm, siliciu 5000 Ohm / cm, seleniu 100 000 Ohm / cm. Rezistivitatea acestui grup este mai mare decât cea a conductoarelor rele, dar mai mică decât cea a izolatorilor răi, ca să nu mai vorbim de cei buni. Probabil, cu același succes, semiconductorii ar putea fi numiți semizolatori.
După o cunoaștere atât de scurtă cu structura și proprietățile unui atom, ar trebui să luăm în considerare modul în care atomii interacționează între ei, modul în care atomii interacționează între ei, modul în care sunt fabricate molecule din care sunt compuse diverse substanțe. Pentru a face acest lucru, va trebui din nou să vă amintiți de electronii de pe orbita exterioară a atomului. La urma urmei, ei sunt cei care participă la legarea atomilor în molecule și determină proprietățile fizice și chimice ale materiei.
Cum se formează atomii din atomi
Orice atom este într-o stare stabilă dacă există 8 electroni pe orbita sa exterioară. Nu caută să ia electroni din atomii vecini, dar nu renunță la ai săi. Pentru a verifica acest lucru, este suficient în tabelul periodic să analizăm gazele inerte: neon, argon, kripton, xenon. Fiecare dintre ei are 8 electroni în orbita exterioară, ceea ce explică reticența acestor gaze să intre în orice relații (reacții chimice) cu alți atomi, pentru a construi molecule de substanțe chimice.
Situația este cu totul diferită pentru acei atomi care nu au 8 electroni prețuiți pe orbita lor exterioară. Astfel de atomi preferă să se unească cu alții pentru a-și suplimenta orbita exterioară cu până la 8 electroni și pentru a găsi o stare stabilă calmă.
De exemplu, binecunoscuta moleculă de apă H2O. Este format din doi atomi de hidrogen și un atom de oxigen, așa cum se arată în figură. 1.
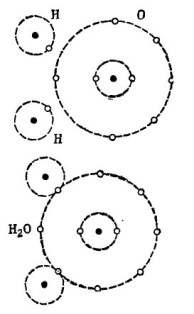
imagine 1. Cum este creată o moleculă de apă.
În partea superioară a figurii, doi atomi de hidrogen și un atom de oxigen sunt arătați separat. Există 6 electroni în orbita exterioară a oxigenului și doi electroni la doi atomi de hidrogen sunt în apropiere. Oxigenul până la prețuitul număr 8 lipsește doar doi electroni în orbita exterioară, pe care îi va primi adăugând în sine doi atomi de hidrogen.
Fiecare atom de hidrogen îi lipsește 7 electroni pe orbita sa exterioară pentru o fericire completă. Primul atom de hidrogen primește pe orbita sa exterioară 6 electroni de oxigen și un alt electron de la geamănul său - al doilea atom de hidrogen. Acum există 8 electroni în orbita sa exterioară împreună cu electronul său. Al doilea atom de hidrogen își completează orbita exterioară până la râvnitul număr 8. Acest proces este prezentat în partea inferioară a figurii. 1.
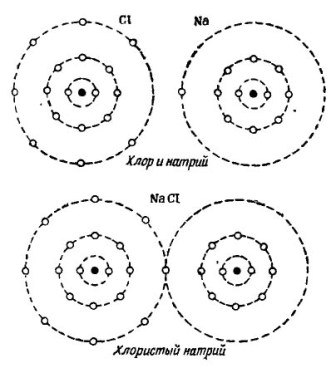
În imagine 2 Procesul de combinare a atomilor de sodiu și clor este prezentat. Rezultatul este clorura de sodiu, care se vinde în magazinele numite sare.
imagine 2. Procesul de combinare a atomilor de sodiu și clor
Tot aici, fiecare dintre participanți primește numărul lipsă de electroni de la celălalt: clorul atașează un singur electron de sodiu la cei șapte electroni proprii, în timp ce își dă atomii de atomul de sodiu. Ambii atomi din orbita exterioară au 8 electroni, ceea ce înseamnă că se obține acordul deplin și prosperitatea.
Valența atomilor
Atomii cu 6 sau 7 electroni în orbita lor exterioară tind să atașeze 1 sau 2 electroni la ei înșiși. Ei spun despre astfel de atomi că sunt unul sau divalenți. Dar dacă în orbita exterioară a unui atom 1, 2 sau 3 electroni, un astfel de atom tinde să le ofere. În acest caz, atomul este considerat unul, două sau trivalente.
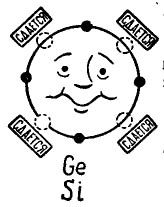
Dacă în orbita exterioară a unui atom există 4 electroni, atunci un astfel de atom preferă să se combine cu același, care are și 4 electroni. Așa se combină atomii de germaniu și siliciu folosiți în producerea tranzistoarelor. În acest caz, atomii sunt numiți tetravalenți. (Atomii de germaniu sau siliciu pot fi combinați cu alte elemente, de exemplu, oxigen sau hidrogen, dar acești compuși nu sunt interesanți în planul poveștii noastre.)
În imagine 3 este prezentat un atom de germaniu sau siliciu care dorește să se combine cu același atom. Micile cercuri negre sunt electronii proprii ai atomului, iar cercurile de lumină indică locurile în care cad electronii celor patru atomi - vecini -.
imagine 3. Atom de germaniu (siliciu).
Structura cristalină a semiconductorilor
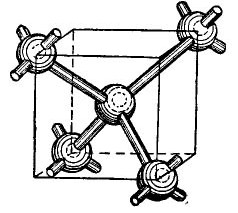
Atomii de germaniu și siliciu din tabelul periodic sunt în același grup cu carbonul (formula chimică a diamantului C este pur și simplu cristale mari de carbon obținute în anumite condiții) și, prin urmare, atunci când sunt combinate, formează o structură cristalină asemănătoare cu diamantul. Formarea unei astfel de structuri este arătată, într-o perspectivă simplificată, desigur 4.
imagine 4.
În centrul cubului se află un atom de germaniu, iar în colțuri sunt localizați încă 4 atomi. Atomul descris în centrul cubului este legat de electronii săi de valență de vecinii săi cei mai apropiați. La rândul lor, atomii unghiulari își dau electronii de valență atomului situat în centrul cubului și vecinilor săi - atomi care nu sunt prezentați în figură. Astfel, orbitele exterioare sunt completate cu până la opt electroni. Desigur, nu există cub în zăbrele de cristal, este prezentat doar în figură, astfel încât aranjarea reciprocă, volumetrică a atomilor să fie clară.
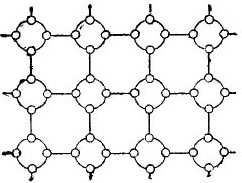
Însă pentru a simplifica cât mai mult povestea despre semiconductori, rețeaua de cristal poate fi descrisă ca un desen schematic plat, în ciuda faptului că legăturile interatomice sunt totuși localizate în spațiu. Un astfel de circuit este prezentat în figură. 5.
imagine 5. Zăcămintele de cristal de germaniu într-o formă plană.
Într-un astfel de cristal, toți electronii sunt strâns legați de atomi de legăturile lor de valență, prin urmare, aparent, nu există pur și simplu electroni liberi aici. Se dovedește că în fața noastră este un izolator în figură, deoarece nu există electroni liberi în el. Dar, de fapt, nu este așa.
Conductivitate intrinsecă
Cert este că sub influența temperaturii, unii electroni încă reușesc să se desprindă de atomii lor și, de ceva vreme, să se elibereze de legătura cu nucleul. Prin urmare, există o cantitate mică de electroni liberi într-un cristal de germaniu, datorită căreia este posibil să se conducă un curent electric. Câți electroni liberi există într-un cristal de germaniu în condiții normale?
Nu există mai mult de doi astfel de electroni liberi la 10 ^ 10 (zece miliarde) de atomi, deci germaniul este un conductor sărac, sau este obișnuit să spunem un semiconductor. Trebuie menționat că doar un gram de germaniu conține 10 ^ 22 (zece mii de miliarde de) atomi, ceea ce vă permite să "obțineți" aproximativ două mii de miliarde de electroni liberi. Se pare că este suficient pentru a trece un curent electric mare. Pentru a rezolva această problemă, este suficient să amintim ce este un curent de 1 A.
Un curent de 1 A corespunde trecerii printr-un conductor într-o secundă o sarcină electrică de 1 Coulomb, sau 6 * 10 ^ 18 (șase miliarde de electroni) electroni pe secundă. În acest context, este puțin probabil ca două mii de miliarde de electroni liberi și chiar împrăștiați pe un imens cristal să asigure trecerea curenților înalți. Deși, din cauza mișcării termice, o conductivitate mică în Germania există. Aceasta este așa-numita conductivitate intrinsecă.
Conductivitate electronică și gaură
Pe măsură ce temperatura crește, energia suplimentară este transferată electronilor, vibrațiile lor termice devin mai energice, în urma cărora unii electroni reușesc să se desprindă de atomii lor.Acești electroni devin liberi și, în absența unui câmp electric extern, fac mișcări haotice și se mișcă în spațiul liber.
Atomii care au pierdut electronii nu pot face mișcări aleatorii, ci doar oscilează ușor în raport cu poziția lor normală în rețeaua de cristal. Astfel de atomi, care au pierdut electroni, se numesc ioni pozitivi. Putem presupune că în locul electronilor smulși din atomii lor, se obțin spații libere, care se numesc în mod obișnuit găuri.
În general, numărul de electroni și găuri este același, astfel încât o gaură poate capta un electron care se află în apropiere. Drept urmare, un atom dintr-un ion pozitiv devine din nou neutru. Procesul de combinare a electronilor cu găurile se numește recombinare.
La aceeași frecvență, electronii sunt separați de atomi, prin urmare, în medie, numărul de electroni și găuri pentru un anumit semiconductor este egal cu, este constant și depinde de condițiile externe, în special de temperatură.
Dacă o tensiune este aplicată cristalului cu semiconductor, atunci mișcarea electronilor va fi ordonată, un curent va curge prin cristal datorită conductivității electronului și a găurii. Această conductivitate se numește intrinsecă, a fost deja menționată puțin mai sus.
Dar semiconductorii în forma lor pură, cu conductivitate electronică și la găuri, nu sunt potriviți pentru fabricarea diodelor, tranzistoarelor și a altor detalii, întrucât la baza acestor dispozitive se află joncțiunea p-n (citiți „pe-en”).
Pentru a obține o astfel de tranziție, sunt necesare două tipuri de semiconductori, două tipuri de conductivitate (p - pozitiv - pozitiv, gaură) și (n - negativ - negativ, electronic). Aceste tipuri de semiconductori sunt obținute prin dopare, adăugând impurități la germaniu pur sau cristale de siliciu.
Deși cantitatea de impurități este foarte mică, prezența lor modifică în mare măsură proprietățile semiconductorului, vă permite să obțineți semiconductori cu o conductivitate diferită. Acest lucru va fi discutat în următoarea parte a articolului.
Boris Aladyshkin, https://i.electricianexp.com/ro
Consultați și la i.electricianexp.com
: