categorii: Articole prezentate » Electricieni novici
Numar de vizualizari: 70526
Comentarii la articol: 0
Celule galvanice - dispozitiv, principiul funcționării, tipuri și caracteristici principale
Condiții preliminare pentru apariția celulelor galvanice. Un pic de istorie. În 1786, profesorul italian de medicină, fiziologul Luigi Aloisio Galvani a descoperit un fenomen interesant: mușchii picioarelor posterioare ale unui cadavru proaspăt deschis de o broască suspendată pe cârligele de cupru contractate când savantul le-a atins cu un bisturiu de oțel. Galvani a concluzionat imediat că aceasta a fost o manifestare a „electricității animale”.
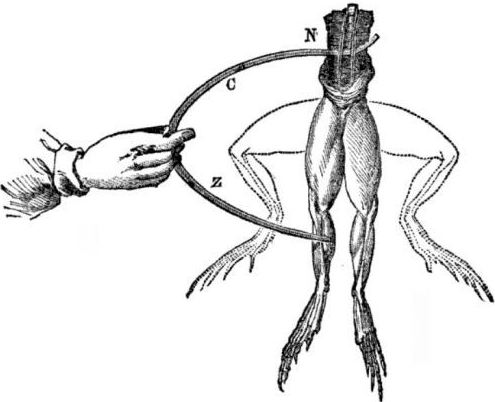
După moartea lui Galvani, contemporanul său Alessandro Volta, ca chimist și fizician, va descrie și va demonstra public un mecanism mai realist pentru apariția curentului electric atunci când diferite metale vin în contact.
După o serie de experimente, Volta va ajunge la concluzia fără echivoc că curentul apare în circuit datorită prezenței în acesta a doi conductori de metale diferite, plasați într-un lichid, iar aceasta nu este deloc „electricitate animală”, așa cum credea Galvani. Răsucirea picioarelor broaștei a fost o consecință a acțiunii curentului care rezultă din contactul diferitelor metale (cârlige de cupru și un bisturiu de oțel).
Volta va arăta aceleași fenomene pe care le-a arătat Galvani pe o broască moartă, dar pe un electrometru de casă complet neînsuflețit, iar în 1800 va oferi o explicație exactă a curentului: „conductorul de clasa a II-a (lichid) este în mijloc și este în contact cu doi conductori de primă clasă din doi diferiți metale ... Ca urmare, apare un curent electric dintr-o direcție sau alta. "

În una dintre primele experimente, Volta a coborât două plăci - zinc și cupru - într-un borcan cu acid și le-a conectat cu sârmă. După aceea, placa de zinc a început să se dizolve și s-au format bule de gaz pe oțelul de cupru. Volta a sugerat și a dovedit că curentul electric curge prin sârmă.
Astfel a fost inventat „elementul Volta” - prima celulă galvanică. Pentru comoditate, Volta i-a dat forma unui cilindru vertical (stâlp), format din inele interconectate de zinc, cupru și pânză impregnate cu acid. Un pol de volt înălțime de jumătate de metru a creat o tensiune sensibilă la oameni.
De la începutul cercetării a fost pus de Luigi Galvani, numele sursa de curent chimic a păstrat amintirea lui în numele său.
Celula galvanică Este o sursă chimică de curent electric, bazată pe interacțiunea a două metale și / sau oxizii acestora într-un electrolit, ceea ce duce la apariția unui curent electric într-un circuit închis. Astfel, în celulele galvanice, energia chimică este transformată în energie electrică.
Celule azi

Celulele astăzi se numesc baterii. Trei tipuri de baterii sunt răspândite: soluție salină (uscată), alcalină (se mai numesc alcaline, „alcaline” în traducere din engleză - „alcaline”) și litiu. Principiul activității lor este același ca cel descris de Volta în 1800: două metale interacționează prin electrolitși un curent electric apare într-un circuit închis extern.
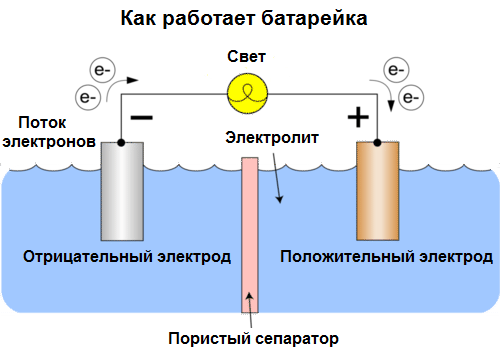
Tensiunea bateriei depinde de metalele utilizate și de numărul de celule din „baterie”. Bateriile, spre deosebire de baterii, nu sunt capabile să-și restabilească proprietățile, deoarece transformă direct energia chimică, adică energia reactivilor (reductant și oxidant) care formează bateria, în energie electrică.
Reactivii incluși în baterie se consumă în timpul funcționării sale, curentul scade treptat, prin urmare, acțiunea sursei se termină după ce reactivii reacționează complet.
Elementele alcaline și sărate (bateriile) sunt utilizate pe scară largă pentru a alimenta o varietate de dispozitive electronice, echipamente radio, jucării și litiu pot fi găsite cel mai adesea în dispozitive medicale portabile, cum ar fi glucometre sau în tehnologia digitală, cum ar fi camerele de luat vederi.

Baterii cu sare
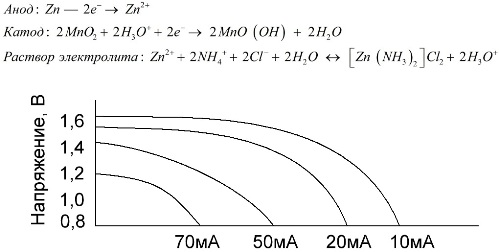
Celulele de mangan-zinc, care sunt numite baterii cu sare, sunt celule galvanice „uscate”, în interiorul cărora nu există o soluție de electroliți lichizi.
Un electrod de zinc (+) este un catod în formă de cupă, iar un amestec pulverulent de dioxid de mangan și grafit servește ca anod. Curentul curge printr-o tijă de grafit. Ca electrolit, se folosește o pastă dintr-o soluție de clorură de amoniu cu adaos de amidon sau făină pentru a se îngroșa, astfel încât să nu curgă nimic.
În mod obișnuit, producătorii de baterii nu indică compoziția exactă a elementelor de sare, cu toate acestea, bateriile cu sare sunt cele mai ieftine, de obicei sunt utilizate în dispozitivele în care consumul de energie este extrem de scăzut: în ore, în telecomenzi, în termometre electronice etc.

Conceptul de „capacitate nominală” este rar folosit pentru a caracteriza bateriile de mangan-zinc, deoarece capacitatea lor depinde foarte mult de condițiile și condițiile de operare. Principalele dezavantaje ale acestor elemente sunt o rată semnificativă de reducere a tensiunii pe întreaga descărcare și o scădere semnificativă a capacității de ieșire odată cu creșterea curentului de descărcare. Tensiunea finală de descărcare este setată în funcție de sarcina cuprinsă între 0,7-1,0 V.
Nu numai amploarea curentului de descărcare este importantă, ci și programul de încărcare a timpului. Cu descărcări intermitente de curenți mari și medii, performanța bateriilor crește semnificativ în comparație cu funcționarea continuă. Cu toate acestea, cu curenți mici de descărcare și luni de întreruperi în funcționare, capacitatea lor poate scădea ca urmare a descărcării de sine.
Graficul de mai sus prezintă curbele de descărcare pentru o baterie de sare medie pentru 4, 10, 20 și 40 de ore pentru comparație cu una alcalină, despre care vom discuta mai târziu.
Baterii alcaline (alcaline)
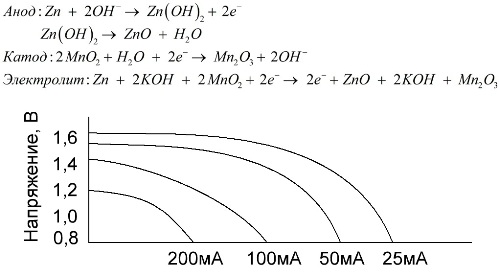
O baterie alcalină este o baterie galvanică de mangan-zinc, în care dioxidul de mangan este folosit ca catod, zincul pudră este folosit ca anod și o soluție alcalină este folosită ca electrolit, de obicei sub formă de pastă de hidroxid de potasiu.
Aceste baterii prezintă o serie de avantaje (în special, o capacitate semnificativ mai mare, performanțe mai bune la temperaturi scăzute și curenți mari de încărcare).

Bateriile alcaline, în comparație cu soluția salină, pot oferi un curent mai lung pentru o lungă perioadă de timp. Un curent mai mare devine posibil, deoarece zincul este folosit aici nu sub forma unui pahar, ci sub forma unei pulberi care are o zonă de contact mai mare cu electrolitul. Ca electrolit se utilizează hidroxid de potasiu sub formă de pastă.
Datorită capacității acestui tip de celule galvanice de a furniza un curent semnificativ (până la 1 A) pentru o lungă perioadă de timp, bateriile alcaline sunt cele mai frecvente în prezent.
În jucăriile electrice, în echipamentele medicale portabile, în dispozitivele electronice, în camerele de fotografiat, bateriile alcaline sunt folosite peste tot. Ele servesc de 1,5 ori mai mult decât soluția salină dacă evacuarea este cu curent scăzut. Graficul prezintă curbele de descărcare la curenți diferiți pentru comparație cu o baterie cu sare (graficul a fost prezentat mai sus) timp de 4, 10, 20 și 40 de ore.
Baterii cu litiu
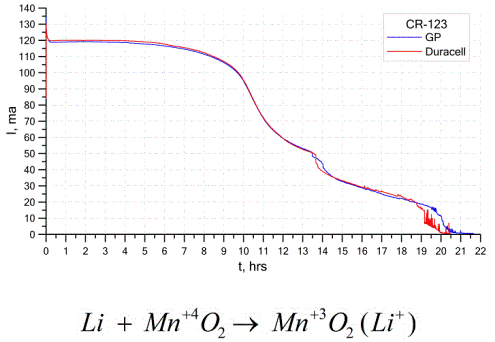
Un alt tip destul de comun de celule galvanice sunt bateriile cu litiu - celule galvanice unice neîncărcabile în care litiu sau compușii săi sunt folosiți ca anod. Datorită utilizării metalului alcalin, acestea au o diferență mare de potențial.

Catodul și electrolitul unei celule de litiu pot fi foarte diferite, deci termenul „celulă de litiu” combină un grup de celule cu același material anodic.Ca catod, de exemplu, pot fi utilizate dioxidul de mangan, monofluorura de carbon, piritul, clorura de tionil etc.
Bateriile cu litiu se diferențiază de celelalte baterii prin timpul lor de rulare și costul ridicat. În funcție de dimensiunea și materialele chimice utilizate, o baterie de litiu poate produce tensiuni de la 1,5 V (compatibile cu bateriile alcaline) până la 3,7 V.
Aceste baterii au cea mai mare capacitate pe unitate de masă și o durată de valabilitate îndelungată. Celulele de litiu sunt utilizate pe scară largă în echipamentele electronice portabile moderne: pentru alimentarea ceasurilor de pe placi de bază ale computerului, pentru alimentarea dispozitivelor medicale portabile, a ceasurilor, calculatoarelor, în echipamente fotografice etc.
Graficul de mai sus prezintă curbele de descărcare pentru două baterii de litiu de la doi producători populari. Curentul inițial a fost de 120 mA (per rezistor de ordinul a 24 Ohmi).
Vezi și: Baterii reîncărcabile moderne - avantaje și dezavantaje
Consultați și la i.electricianexp.com
: