categorieën: Aanbevolen artikelen » Beginnende elektriciens
Aantal keer bekeken: 70526
Reacties op het artikel: 0
Galvanische cellen - apparaat, werkingsprincipe, types en hoofdkenmerken
Vereisten voor het uiterlijk van galvanische cellen. Een beetje geschiedenis. In 1786 ontdekte de Italiaanse professor in de geneeskunde, fysioloog Luigi Aloisio Galvani, een interessant fenomeen: de spieren van de achterpoten van een pas geopend lijk van een kikker opgehangen aan koperen haken samentrokken toen de wetenschapper ze met een stalen scalpel aanraakte. Galvani concludeerde onmiddellijk dat dit een manifestatie was van 'dierlijke elektriciteit'.
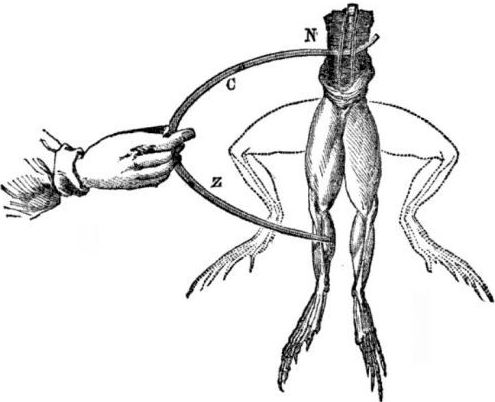
Na de dood van Galvani zal zijn tijdgenoot Alessandro Volta, als chemicus en natuurkundige, een realistischer mechanisme beschrijven en demonstreren voor het optreden van elektrische stroom wanneer verschillende metalen in contact komen.
Volta zal na een reeks experimenten tot de ondubbelzinnige conclusie komen dat de stroom in het circuit verschijnt vanwege de aanwezigheid erin van twee geleiders van verschillende metalen die in een vloeistof zijn geplaatst, en dit is helemaal geen "dierlijke elektriciteit", zoals Galvani dacht. Het trillen van de poten van de kikker was een gevolg van de werking van de stroom die ontstaat door het contact van verschillende metalen (koperen haken en een stalen scalpel).
Volta zal dezelfde fenomenen laten zien die Galvani liet zien op een dode kikker, maar op een volledig levenloze zelfgemaakte elektrometer, en in 1800 geeft een nauwkeurige uitleg van de stroom: “de tweedeklassergeleider (vloeistof) bevindt zich in het midden en staat in contact met twee eersteklas geleiders van twee verschillende metalen ... Als gevolg hiervan ontstaat een elektrische stroom van de ene of de andere richting. "

In een van de eerste experimenten liet Volta twee platen - zink en koper - in een pot zuur zakken en verbond ze met draad. Daarna begon de zinkplaat op te lossen en vormden zich gasbellen op het koperstaal. Volta suggereerde en bewees dat elektrische stroom door de draad stroomt.
Zo werd het "Volta-element" uitgevonden - de eerste galvanische cel. Voor het gemak gaf Volta het de vorm van een verticale cilinder (pijler), bestaande uit onderling verbonden ringen van zink, koper en doek geïmpregneerd met zuur. Een voltpool van een halve meter hoog creëerde een voor mensen gevoelige spanning.
Sinds het begin van het onderzoek werd gelegd door Luigi Galvani, de naam chemische stroombron bewaarde de herinnering aan hem in zijn naam.
Galvanische cel Is een chemische bron van elektrische stroom, gebaseerd op de interactie van twee metalen en / of hun oxiden in een elektrolyt, wat leidt tot het verschijnen van een elektrische stroom in een gesloten circuit. In galvanische cellen wordt dus chemische energie omgezet in elektrische energie.
Cellen vandaag

Cellen worden tegenwoordig batterijen genoemd. Er zijn drie soorten batterijen: zoutoplossing (droog), alkaline (ze worden ook alkaline genoemd, "alkaline" in vertaling uit het Engels - "alkaline") en lithium. Het principe van hun werk is hetzelfde als beschreven door Volta in 1800: twee metalen interactie via elektrolyten een elektrische stroom ontstaat in een extern gesloten circuit.
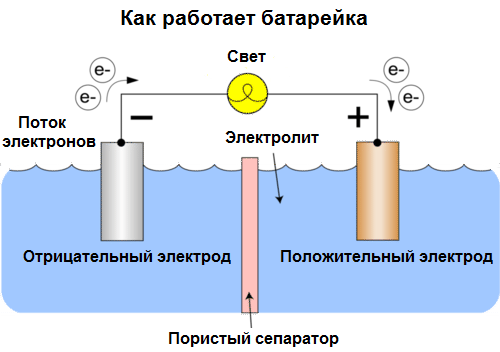
De batterijspanning is afhankelijk van de gebruikte metalen en van het aantal cellen in de "batterij". Batterijen zijn, in tegenstelling tot batterijen, niet in staat hun eigenschappen te herstellen, omdat ze chemische energie, dat wil zeggen de energie van de reagentia (reductiemiddel en oxidatiemiddel) die de batterij vormen, direct in elektrische energie omzetten.
De reagentia in de batterij worden verbruikt tijdens de werking, de stroom neemt geleidelijk af, zodat de actie van de bron eindigt nadat de reagentia volledig reageren.
Alkalische en zoutelementen (batterijen) worden op grote schaal gebruikt om verschillende elektronische apparaten, radioapparatuur, speelgoed en lithium van stroom te voorzien. Meestal zijn ze te vinden in draagbare medische apparaten zoals bloedglucosemeters of in digitale technologie zoals camera's.

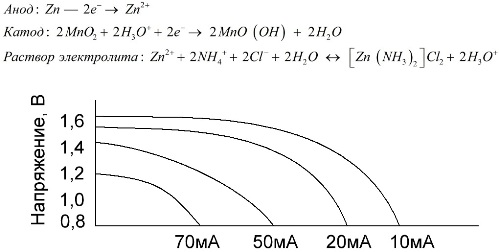
Zout batterijen
Mangaan-zinkcellen, die zoutbatterijen worden genoemd, zijn "droge" galvanische cellen, waarbinnen geen vloeibare elektrolytoplossing aanwezig is.
Een zinkelektrode (+) is een komvormige kathode en een poedervormig mengsel van mangaandioxide en grafiet dient als anode. Stroom vloeit door een grafietstaaf. Als elektrolyt wordt een pasta gebruikt uit een oplossing van ammoniumchloride met toevoeging van zetmeel of bloem om te verdikken, zodat er niets stroomt.
Batterijfabrikanten geven meestal niet de exacte samenstelling van de zoutelementen aan, maar zoutbatterijen zijn het goedkoopst, ze worden meestal gebruikt in apparaten waar het stroomverbruik extreem laag is: in uren, in afstandsbedieningen, in elektronische thermometers, etc.

Het concept van "nominale capaciteit" wordt zelden gebruikt om mangaan-zink-batterijen te karakteriseren, omdat hun capaciteit sterk afhankelijk is van bedrijfsomstandigheden en -omstandigheden. De belangrijkste nadelen van deze elementen zijn een significante mate van spanningsreductie tijdens de ontlading en een significante afname van de uitgangscapaciteit met toenemende ontladingsstroom. De uiteindelijke ontladingsspanning wordt ingesteld afhankelijk van de belasting in het bereik van 0,7-1,0 V.
Het is niet alleen belangrijk de grootte van de ontlaadstroom, maar ook het tijdschema van de belasting. Met intermitterende ontladingen van grote en middelgrote stromen, nemen de prestaties van de batterijen aanzienlijk toe in vergelijking met continu gebruik. Bij kleine ontladingsstromen en maandenlange onderbrekingen tijdens bedrijf kan hun capaciteit echter afnemen als gevolg van zelfontlading.
De bovenstaande grafiek toont de ontladingscurves voor een gemiddelde zoutbatterij gedurende 4, 10, 20 en 40 uur voor vergelijking met een alkalische batterij, die later zal worden besproken.
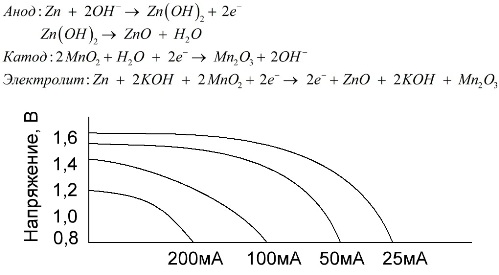
Alkaline (alkaline) batterijen
Een alkalinebatterij is een mangaan-zink galvanische batterij, waarin mangaandioxide wordt gebruikt als een kathode, poedervormig zink wordt gebruikt als een anode en een alkalische oplossing wordt gebruikt als een elektrolyt, meestal in de vorm van een kaliumhydroxidepasta.
Deze batterijen hebben een aantal voordelen (met name een aanzienlijk grotere capaciteit, betere prestaties bij lage temperaturen en hoge belastingsstromen).

Alkalinebatterijen kunnen in vergelijking met zoutoplossing langdurig meer stroom leveren. Een grotere stroom wordt mogelijk omdat zink hier niet in de vorm van een glas wordt gebruikt, maar in de vorm van een poeder met een groter contactoppervlak met de elektrolyt. Kaliumhydroxide in de vorm van een pasta wordt gebruikt als elektrolyt.
Dankzij het vermogen van dit type galvanische cellen om langdurig een significante stroom (tot 1 A) te leveren, zijn alkalinebatterijen tegenwoordig het meest gebruikelijk.
In elektrisch speelgoed, in draagbare medische apparatuur, in elektronische apparaten, in camera's, worden overal alkalinebatterijen gebruikt. Ze dienen 1,5 keer langer dan zoutoplossing als de ontlading lage stroom heeft. De grafiek toont de ontladingskrommen bij verschillende stromen ter vergelijking met een zoutbatterij (de grafiek werd hierboven gegeven) gedurende 4, 10, 20 en 40 uur.
Lithium batterijen
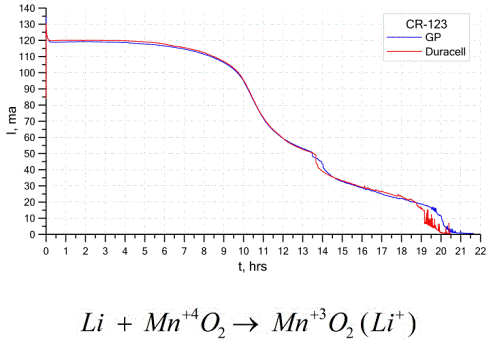
Een ander redelijk gebruikelijk type galvanische cellen zijn lithiumbatterijen - enkele niet-oplaadbare galvanische cellen waarin lithium of zijn verbindingen als anode worden gebruikt. Door het gebruik van alkalimetaal hebben ze een groot potentiaalverschil.

De kathode en elektrolyt van een lithiumcel kunnen erg verschillen, dus de term "lithiumcel" combineert een groep cellen met hetzelfde anodemateriaal.Als een kathode kunnen bijvoorbeeld mangaandioxide, koolstofmonofluoride, pyriet, thionylchloride, enz. Worden gebruikt.
Lithiumbatterijen onderscheiden zich van andere batterijen door hun hoge batterijduur en hoge kosten. Afhankelijk van de gebruikte grootte en chemische materialen, kan een lithiumbatterij spanningen produceren van 1,5 V (compatibel met alkalinebatterijen) tot 3,7 V.
Deze batterijen hebben de hoogste capaciteit per massa-eenheid en zijn lang houdbaar. Lithiumcellen worden veel gebruikt in moderne draagbare elektronische apparatuur: voor het voeden van horloges op computermoederborden, voor het voeden van draagbare medische apparaten, horloges, rekenmachines, in fotoapparatuur, enz.
De bovenstaande grafiek toont de ontladingscurves voor twee lithiumbatterijen van twee populaire fabrikanten. De initiële stroom was 120 mA (per weerstand in de orde van 24 Ohm).
Zie ook op bgv.electricianexp.com
: