categorieën: Aanbevolen artikelen » Interessante feiten
Aantal keer bekeken: 14188
Reacties op het artikel: 1
Waarom exploderen batterijen
 Gebruikers van smartphones en tablets zijn zich natuurlijk bewust van het explosiegevaar van lithiumbatterijen in hun gadgets. En opvallende voorbeelden hoeven niet ver te gaan. Onlangs had Samsung bijvoorbeeld te maken met een pijnlijk probleem en moest de eerste reeks van de nieuwe Note 7 intrekken, omdat de batterijen tijdens het opladen explodeerden. Op de een of andere manier blijft het probleem hetzelfde vanaf het begin van de verschijning van mobiele telefoons; zelfs in 2016 verbood ICAO commerciële zendingen in de vrachtcompartimenten van civiel vervoer lithium batterijen.
Gebruikers van smartphones en tablets zijn zich natuurlijk bewust van het explosiegevaar van lithiumbatterijen in hun gadgets. En opvallende voorbeelden hoeven niet ver te gaan. Onlangs had Samsung bijvoorbeeld te maken met een pijnlijk probleem en moest de eerste reeks van de nieuwe Note 7 intrekken, omdat de batterijen tijdens het opladen explodeerden. Op de een of andere manier blijft het probleem hetzelfde vanaf het begin van de verschijning van mobiele telefoons; zelfs in 2016 verbood ICAO commerciële zendingen in de vrachtcompartimenten van civiel vervoer lithium batterijen.
De essentie van het probleem met lithiumbatterijen
Het feit is dat tijdens het opladen van een lithiumbatterij in een mobiel apparaat, met behulp van de in de batterij ingebouwde microcontroller, een vrij gecompliceerd algoritme voor het implementeren van dit proces is geïmplementeerd, zodat de batterijtemperatuur niet buiten het acceptabele temperatuurbereik komt. De controller bewaakt voor dit doel vele parameters van de batterij tijdens het opladen.
Naast het laadproces zelf, vereist opslag van de batterij ook naleving van bepaalde regels, vooral met betrekking tot temperatuur: u kunt de batterij niet oververhitten of onderkoelen.

Het grootste probleem waardoor batterijen exploderen is overmatige verhitting van de elektrolyt door overschrijding van de toegestane temperatuur of door kortsluiting in de batterijcel. De kettingreactie wordt gemakkelijk geïnitieerd in de oververhitte cel, omdat het alkalimetaallithium zeer gemakkelijk wordt ontstoken, waardoor de batterij opzwelt en in het ergste geval explodeert.
En zelfs ondanks de aanwezigheid van een "attente" controller, kan een accidenteel fabrieksdefect (onvoldoende dikte van de isolator tussen de cellen) optreden en tot trieste gevolgen leiden.
Natuurlijk zijn shock, storingen, lekke banden, oververhitting in de zon gevaarlijk. Zelfs als de batterij is gevallen en lichtjes is geraakt, kan er binnen in de isolator een defect optreden en dit kan in de toekomst leiden tot plotselinge problemen, zelfs zonder duidelijke oververhitting.
Reden voor explosie voor lithiumbatterijen
De anode en kathode van de lithium-ionbatterij worden gescheiden door een poreuze polymere scheider. De kathode heeft een actief materiaal, waarvoor vaak oxiden van overgangsmetalen worden gebruikt, waarin lithiumionen zijn ingebed. De anode is meestal grafiet. Een organische oplossing van lithiumzouten wordt gebruikt als elektrolyt.
Tijdens de eerste lading in de fabriek wordt lithium in de anode ingebouwd en vormt zich een laag ontleed elektrolyt op de elektroden, die nu dient als bescherming tegen onnodige reacties, terwijl het ionengeleidend blijft.
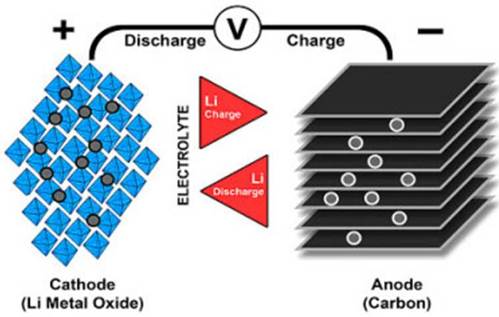
Zoals hierboven opgemerkt, is interne kortsluiting een van de belangrijkste oorzaken van zelfontbranding van de batterij. De oorzaak van de kortsluiting zelf kan fysieke schade of fabrieksfouten zijn, zoals ongelijkmatig snijden van de elektroden of het binnendringen van metaaldeeltjes tussen de kathode en de anode, die de integriteit van de scheidingslaag schenden.
Een andere reden voor de sluiting is de groei van lithiummetalen kettingen door de separator (als de lithiumionen in de fabriek niet genoeg tijd hadden om volledig te integreren in het anodekristal als gevolg van overmatig snel opladen of door overkoeling, of als de capaciteit van het actieve materiaal van de kathode groter is dan de capaciteit van de anode, wat leidt tot afzettingen op de anode, die dan langzaam maar onverbiddelijk groeit).
Dus, als er kortsluiting optreedt, begint de batterijtemperatuur te stijgen en wanneer deze 70-90 ° C bereikt, begint de ontleding van de beschermende ionengeleidende laag van de anode. De lithiumanode reageert met een elektrolyt en er komen ontvlambare koolwaterstoffen zoals ethyleen, methaan, ethaan, enz. Vrij.Maar het is te vroeg voor het vuur, omdat er niet genoeg zuurstof is.
Ondertussen is de exotherme reactie aan en stijgt de temperatuur, de druk in de batterijhouder stijgt. Bij 180-200 ° C begint de disproportioneringsreactie bij de kathode, waar zuurstof vrijkomt. Ontsteking treedt op, de temperatuur stijgt scherp en het elektrolyt ontleedt thermisch, de temperatuur is al 200-300 ° C.
Eindelijk is het de beurt aan grafiet en wanneer de temperatuur 660 ° C bereikt, begint het aluminium van de stroomcollector te smelten. De maximale temperatuur in dit hele proces heeft meestal geen tijd om 900 ° C te overschrijden, omdat alles snel eindigt met de volledige ontleding van de interne componenten van de batterij.

Er is al succes bij het vinden van een oplossing voor het probleem
Om het probleem op te lossen, kunnen fabrikanten van smartphones de regelgeving aanscherpen, extra zekeringen aanbrengen in apparaten en in batterijen, controllers ingewikkelder maken, maar dit verhoogt de kosten van batterijen en alle producten die met een batterij worden geleverd. Bedrijven concurreren met elkaar en kunnen het eenvoudigweg economisch niet.
Ondertussen vechten fysici van Stanford voor de veiligheid van lithiumbatterijen, die in de zomer van 2015 een speciaal beschermend mechanisme ontwikkelden dat al in de productiefase in de batterij is ingebouwd.
We hebben het in feite over een nieuw type lithiumbatterijen, die automatisch worden uitgeschakeld wanneer hun binnenkant een potentieel gevaarlijke temperatuur bereikt (wat voorkomt dat het proces leidt tot daaropvolgende brand), en na een tijdje, na afkoeling, worden ze automatisch weer ingeschakeld.
De auteurs van de ontwikkeling beweren dat dit de eerste lithiumbatterij is die herhaaldelijk kan worden uitgeschakeld en hersteld zonder zijn eigenschappen en prestaties te verliezen.
De ontwikkeling werd gedurende meerdere jaren uitgevoerd door een team van verschillende mensen (inclusief Zhenan Bao), waardoor een batterij twee belangrijke nadelen had - een sterke afname van de batterijcapaciteit na verschillende oplaadcycli en, nog belangrijker, een neiging tot brand en explosie als gevolg van oververhitting ( kettingreactie stopt automatisch).
De beslissing viel bij wetenschappers uit een heel ander vakgebied. Ze maakten thermometers met behulp van nikkel nanodeeltjes ingebed in een dunne laag grafeen en plastic. Dit waren ongebruikelijke thermometers. In rust waren de nikkeldeeltjes in contact met elkaar, dat wil zeggen dat een goede stroomgeleider werd verkregen. Maar toen de plaat werd verwarmd, begon het plastic een beetje uit te zetten, wat leidde tot een verzwakking van het contact tussen de geleidende nikkeldeeltjes en de weerstand van de gehele geleider nam toe.
Deze eigenschap werd gebruikt door onderzoekers van Stanford voor onmiddellijke automatische bescherming van lithiumbatterijen en voor volledig automatisch herstel van contact na koeling. Ze lijmden een vel van zo'n plastic op een van de elektroden van de batterij zodat het geleidingsvermogen zou verliezen bij toenemende temperatuur. En wanneer de temperatuur 70 ° C bereikt

Maar ondanks de oplossing, durven fabrikanten van mobiele apparaten nog steeds niet de productietechnologie van hun batterijen die in de loop van de jaren is ontwikkeld drastisch te veranderen. Daarom moeten gebruikers van gadgets het potentiële gevaar van lithiumbatterijen enige tijd onder ogen zien en proberen hun mobiele apparaten, en met name batterijen, niet te laten vallen of oververhitten. Misschien zal het probleem in de nabije toekomst volledig worden opgelost.
Zie ook op bgv.electricianexp.com
:
