Kategorijas: Piedāvātie raksti » Iesācēju elektriķi
Skatījumu skaits: 36288
Komentāri par rakstu: 1
Ķīmisko strāvu avoti: galvenie raksturlielumi
 Cilvēce vairāk nekā divus gadsimtus ir izmantojusi ķīmisku reakciju enerģiju starp dažādām vielām, lai iegūtu līdzstrāvu.
Cilvēce vairāk nekā divus gadsimtus ir izmantojusi ķīmisku reakciju enerģiju starp dažādām vielām, lai iegūtu līdzstrāvu.
Darba princips
Redoksreakcija, kas notiek starp vielām ar oksidētāja un reducētāja īpašībām, pavada elektronu izdalīšanos, kuru kustība veido elektrisko strāvu. Tomēr, lai izmantotu savu enerģiju, ir jārada apstākļi elektronu pārejai caur ārēju ķēdi, pretējā gadījumā to atbrīvo siltums no vienkārša oksidētāja un reducētāja maisījuma.
Tāpēc visiem ķīmiskās strāvas avotiem ir divi elektrodi:
-
anoda, uz kuras notiek oksidēšanās;
-
katods, veicot vielas atjaunošanu.
Elektrodi no attāluma tiek ievietoti traukā ar elektrolītu - vielu, kas vada elektrisko strāvu, pateicoties barotnes disociācijas procesiem joniem.
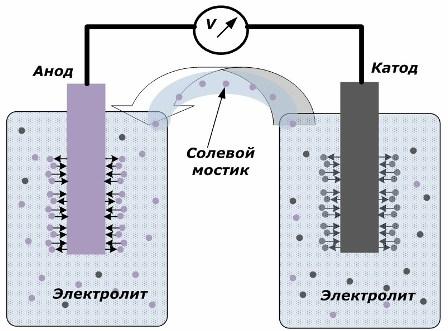
Ķīmiskās enerģijas pārvēršanas elektriskajā enerģijā princips
Attēlā parādīts, ka elektrodi ir ievietoti atsevišķos traukos, kas savienoti ar sāls tiltu, caur kuru tiek izveidota jonu kustība pa iekšējo ķēdi. Kad ārējās un iekšējās ķēdes ir atvērtas, uz elektrodiem notiek divi procesi: jonu pāreja no elektrodu metāla uz elektrolītu un jonu pāreja no elektrolīta uz elektrodu kristāla režģi.
Šo procesu plūsmas ātrumi ir vienādi, un uz katra elektrodu tiek uzkrāti pretēju zīmju sprieguma potenciāli. Ja tie ir savienoti caur sāls tiltu un tiek piemērota slodze, rodas elektriskā ķēde. Iekšējo strāvu rada jonu kustība starp elektrodiem caur elektrolītu un sāls tiltu. Elektronu kustība pa ārējo ķēdi virzienā no anoda uz katodu.
Gandrīz visas redoksreakcijas pavada elektrības ražošana. Bet tā vērtība ir atkarīga no daudziem faktoriem, ieskaitot izmantoto ķīmisko vielu apjomus un masas, elektrodus izgatavošanai izmantotos materiālus, piemēram, elektrolītus, jonu koncentrāciju, dizainu.
Mūsdienu ķīmiskajos strāvas avotos visplašāk tiek izmantoti:
-
anoda materiālam (reducētājam), cinkam (Zn), svinam (Pb), kadmijam (Cd) un dažiem citiem metāliem;
-
katoda materiālam (oksidētājam) - svina oksīds PbO2, mangāna oksīds MnO2, niķeļa hidroksīds NiOOH un citi;
-
elektrolīti uz skābju, sārmu vai sāļu šķīdumiem.
Klasifikācijas metodes
Vienu ķīmisko enerģijas avotu daļu var izmantot atkārtoti, bet otru nevar. Šis princips tiek ņemts par pamatu viņu klasifikācijai.
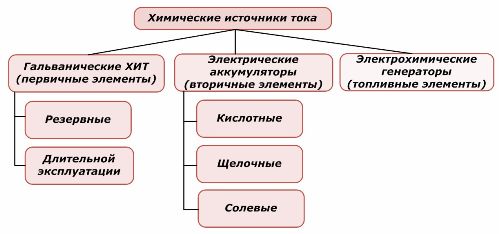
Ķīmisko elementu klasifikācija
Elektromotora spēks galvaniskās šūnasatkarībā no konstrukcijas sasniedz 1,2 ÷ 1,5 voltus. Lai iegūtu lielas vērtības, tās tiek apvienotas baterijās, savienojot virknē. Kad baterijas ir savienotas paralēli, palielinās strāva un jauda.
Ir vispārpieņemts, ka primārie ķīmiskie strāvas avoti neatbalsta atkārtotu uzlādi, lai gan precīzāk šo nostāju var formulēt atšķirīgi: tās īstenošana nav ekonomiski iespējama.
Pārmērīgus primāro ķīmisko strāvu avotus glabā tādā stāvoklī, kurā elektrolīts ir izolēts no elektrodiem. Tas novērš redoksreakcijas rašanos un nodrošina gatavību nodošanai ekspluatācijā. Tos neizmanto atkārtoti. Ķīmisko rezerves enerģijas avotu glabāšanas laiks ir ierobežots līdz 10–15 gadiem.
Baterijas tiek veiksmīgi uzlādētas, izmantojot ārēju elektrisko enerģiju. Sakarā ar šo īpašību tos sauc par sekundāriem strāvas avotiem. Viņi spēj izturēt simtiem un tūkstošiem uzlādes ciklu.Akumulatora EML var būt diapazonā no 1,0 ÷ 1,5 voltiem. Tos apvieno arī baterijās.
Elektroķīmiskie ģeneratori darbojas pēc galvanisko elementu principa, taču tie ved vielas no ārpuses, lai vadītu elektroķīmisko reakciju, un visi atbrīvotie produkti tiek noņemti no elektrolīta. Tas ļauj organizēt nepārtrauktu procesu.
Galvenie ķīmisko enerģijas avotu darbības parametri
1. Spriegums atvērtos spailēs
Atkarībā no konstrukcijas viens avots var radīt tikai noteiktu potenciālu atšķirību. Izmantošanai elektriskās ierīcēs tie tiek apvienoti akumulatoros.
2. Īpašā ietilpība
Noteiktu laiku (stundās) viens ķīmiskās strāvas avots var radīt ierobežotu daudzumu strāvas (ampēros), ko attiecina uz svara vai tilpuma vienību.
3. Jaudas blīvums
Tas raksturo ķīmiskās strāvas avota svara vienības vai tilpuma vienības spēju radīt strāvas stipruma dēļ enerģiju, ko rada sprieguma produkts.
4. Darbības ilgums
Šo parametru sauc arī par derīguma termiņu.
5. Pašizlādes strāvu vērtība
Šie elektroķīmisko reakciju sānu procesi noved pie elementu aktīvās masas patērēšanas, izraisa koroziju un samazina īpatnējo kapacitāti.
6. Produkta cena
Atkarīgs no konstrukcijas, izmantotajiem materiāliem un vairākiem citiem faktoriem.
Labākie ķīmisko strāvas avoti ir tie, kuriem ir augstas pirmo četru parametru vērtības, un pašizlāde un izmaksas ir zemas.
Akumulatora uzlādes principi
Starp sekundārajiem pašreizējiem ķīmiskajiem avotiem tie iegūst lielu popularitāti. litija jonu modeļi, kuras ir plaši izmantotas elektronisko ierīču darbināšanai. Viņi izmanto LiMO2 (M Co, Ni, Mn) kā pozitīvā elektroda materiālu, bet grafītu kā negatīvo.
Uzlādējot, litija joni no pielietotās ārējās enerģijas tiek atbrīvoti no katoda metāla, iziet cauri elektrolītam un iekļūst telpā starp grafīta slāņiem, uzkrājoties tur.
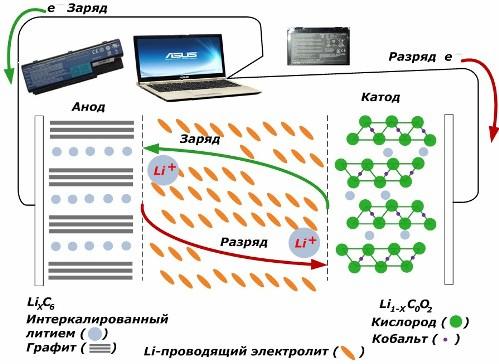
Kad enerģija lādētājs nav, un slodze ir savienota ar elektrodiem, tad litija joni elektrolītā pārvietojas pretējā virzienā.
Ja uzlāde un izlāde netiek veikta, akumulatora enerģija netiek patērēta, bet tiek uzkrāta. Bet tā daudzumu ierobežo izmantoto materiālu īpašības. Piemēram, litija jonu akumulatoros īpatnējā elektriskā jauda ir 130 ÷ 150 mAh / g. To ierobežo anoda materiāla īpašības. Grafīta ietilpība ir aptuveni divas reizes lielāka.
Zinātnieki tagad meklē veidus, kā palielināt akumulatora ietilpību, pēta iespēju izmantot ķīmisku reakciju starp litiju un gaisā esošo skābekli. Lai to izdarītu, dizainparaugi tiek izstrādāti ar gaisu, neizmantojamu katodu, ko izmanto atsevišķās baterijās. Šī metode var palielināt enerģijas blīvumu līdz 10 reizēm.
Ķīmisko strāvas avotu darbībai ir vajadzīgas zināšanas elektrotehnikas pamati, elektroķīmija, materiālu zinātne un cietvielu fizika.
Skatīt arī vietnē i.electricianexp.com
: