Kategorijos: Teminiai straipsniai » Pradedantieji elektrikai
Peržiūrų skaičius: 70526
Straipsnio komentarai: 0
Galvaniniai elementai - įtaisas, veikimo principas, tipai ir pagrindinės charakteristikos
Galvaninių elementų atsiradimo prielaidos. Šiek tiek istorijos. 1786 m. Italų medicinos profesorius, fiziologas Luigi Aloisio Galvani atrado įdomų reiškinį: šviežiai atsivėrusio varlės lavono, pakabinto ant varinių kabliukų, užpakalinių kojų raumenys susitraukė, kai mokslininkas juos palietė plieniniu skalpeliu. Galvani iškart padarė išvadą, kad tai buvo „gyvulinės elektros“ apraiška.
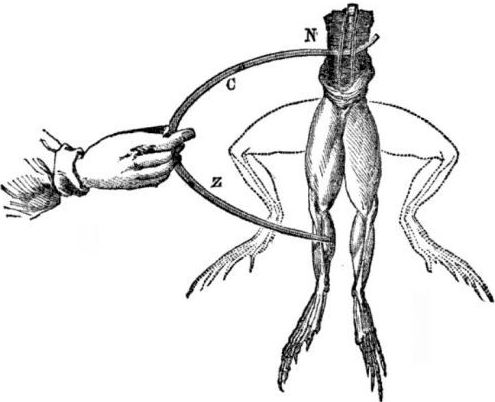
Miręs Galvani, jo šiuolaikinis Alessandro Volta, kaip chemikas ir fizikas, aprašys ir viešai pademonstruos realistiškesnį elektros srovės atsiradimo mechanizmą, kai liečiasi skirtingi metalai.
„Volta“ po daugybės eksperimentų pateiks vienareikšmišką išvadą, kad srovė atsiranda grandinėje dėl to, kad joje yra du skirtingų skystyje esančių metalų laidininkai, ir tai visai nėra „gyvulinė elektra“, kaip manė Galvani. Varlės kojų trūkčiojimas buvo srovės, atsirandančios sąlyčio su įvairiais metalais (vario kabliai ir plieninis skalpelis), pasekmė.
„Volta“ parodys tuos pačius reiškinius, kuriuos demonstravo „Galvani“ ant negyvos varlės, tačiau ant visiškai negyvo namie pagaminto elektrometro, o 1800 m. Pateiks tikslų srovės paaiškinimą: „antros klasės laidininkas (skystis) yra viduryje ir liečiasi su dviem skirtingų klasių pirmos klasės laidininkais. metalai ... Dėl to atsiranda vienos ar kitos krypties elektros srovė. “

Viename iš pirmųjų eksperimentų „Volta“ nuleido dvi plokšteles - cinką ir varį - į indą su rūgštimi ir sujungė su viela. Po to cinko plokštelė pradėjo tirpti, o ant vario plieno susidarė dujų burbuliukai. Volta pasiūlė ir įrodė, kad per laidą teka elektros srovė.
Taigi buvo išrastas „Volta elementas“ - pirmoji galvaninė ląstelė. Patogumui „Volta“ jam suteikė vertikalaus cilindro (statramsčio) formą, sudarytą iš sujungtų žiedų iš cinko, vario ir audinio, įmirkyto rūgštimi. Pusės metro aukščio voltos polius sukūrė žmonėms jautrią įtampą.
Nuo pat tyrimo pradžios buvo pavadintas Luigi Galvani cheminis srovės šaltinis išsaugojo jo atminimą jo vardu.
Galvaninė ląstelė Tai cheminis elektros srovės šaltinis, pagrįstas dviejų metalų ir (arba) jų oksidų sąveika elektrolite, sukeliantis elektros srovės atsiradimą uždaroje grandinėje. Taigi galvaninėse ląstelėse cheminė energija paverčiama elektros energija.
Ląstelės šiandien

Ląstelės šiandien vadinamos baterijomis. Plačiai paplitę trijų tipų akumuliatoriai: fiziologinis tirpalas (sausas), šarminis (vertimo iš anglų k. Jie dar vadinami šarminiais, „šarminiais“ - „šarminiais“) ir ličio. Jų darbo principas yra tas pats, kaip 1800 metais aprašė Volta: du metalai sąveikauja per elektrolitą, o išorinėje uždaroje grandinėje atsiranda elektros srovė.
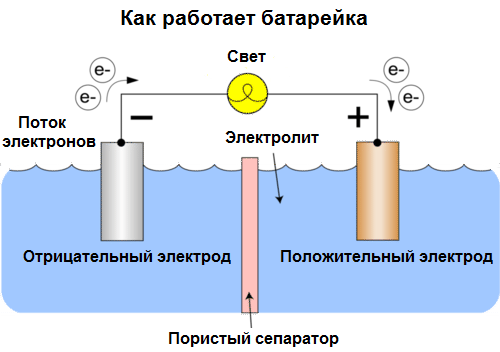
Akumuliatoriaus įtampa priklauso nuo naudojamų metalų ir nuo „akumuliatoriaus“ elementų skaičiaus. Baterijos, skirtingai nei baterijos, negali atkurti savo savybių, nes jos tiesiogiai paverčia cheminę energiją, tai yra, reagentų (reduktoriaus ir oksidatoriaus), kurie sudaro akumuliatorių, energiją į elektros energiją.
Į akumuliatorių įeinantys reagentai sunaudojami jo veikimo metu, srovė pamažu mažėja, todėl šaltinio veikimas baigiasi po to, kai reagentai visiškai sureaguoja.
Šarminiai ir druskos elementai (akumuliatoriai) plačiai naudojami įvairiems elektroniniams prietaisams, radijo įrangai, žaislams ir ličiui maitinti, o ličio dažniausiai galima rasti nešiojamuose medicinos prietaisuose, tokiuose kaip gliukozės kiekio kraujyje matuokliai, arba skaitmeninėse technologijose, tokiose kaip fotoaparatai.

Druskos baterijos
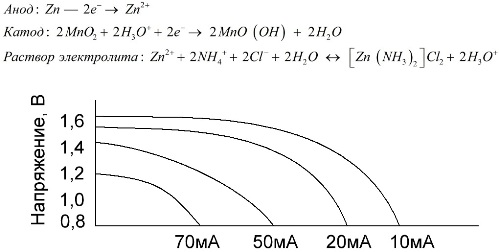
Mangano-cinko elementai, vadinami druskos akumuliatoriais, yra „sausi“ galvaniniai elementai, kurių viduje nėra skysto elektrolito tirpalo.
Cinko elektrodas (+) yra puodelio formos katodas, o miltelinis mangano dioksido ir grafito mišinys naudojamas kaip anodas. Srovė teka per grafito strypą. Kaip elektrolitas pasta tirpalas naudojamas iš amonio chlorido tirpalo pridedant krakmolo ar miltų, kad sutirštėtų, kad nieko netektų.
Paprastai akumuliatorių gamintojai nenurodo tikslios druskos elementų sudėties, tačiau druskos akumuliatoriai yra pigiausi, dažniausiai jie naudojami įrenginiuose, kuriuose energijos suvartojimas yra ypač mažas: valandomis, nuotolinio valdymo pultuose, elektroniniuose termometruose ir kt.

„Nominalios talpos“ sąvoka retai naudojama apibūdinant mangano-cinko baterijas, nes jų talpa labai priklauso nuo eksploatavimo sąlygų ir sąlygų. Pagrindiniai šių elementų trūkumai yra didelis įtampos sumažėjimo greitis visos iškrovos metu ir didelis išėjimo talpos sumažėjimas didėjant iškrovos srovei. Galutinė iškrovos įtampa nustatoma atsižvelgiant į apkrovą 0,7–1,0 V diapazone.
Svarbu ne tik iškrovos srovės dydis, bet ir apkrovos grafikas. Su pertraukiamomis didelių ir vidutinių srovių iškrovomis, palyginti su nuolatiniu veikimu, akumuliatorių veikimas žymiai padidėja. Tačiau esant mažoms iškrovos srovėms ir mėnesiams pertraukiant eksploatavimą, jų pajėgumas gali sumažėti dėl savaiminio iškrovimo.
Aukščiau pateiktoje diagramoje parodytos vidutinės druskos baterijos iškrovos kreivės 4, 10, 20 ir 40 valandų palyginimui su šarminėmis, kurios bus aptartos vėliau.
Šarminės (šarminės) baterijos
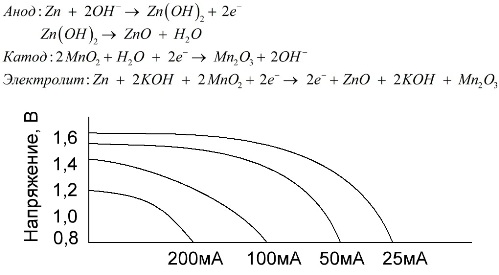
Šarminė baterija yra galvaninė mangano-cinko baterija, kurioje mangano dioksidas naudojamas kaip katodas, cinko milteliai naudojami kaip anodas, o šarmo tirpalas naudojamas kaip elektrolitas, paprastai kalio hidroksido pastos pavidalu.
Šios baterijos turi nemažai pranašumų (visų pirma, žymiai didesnė talpa, geresnis našumas esant žemai temperatūrai ir didelėms apkrovos srovėms).

Šarminės baterijos, palyginti su druskos tirpalu, ilgą laiką gali suteikti daugiau srovės. Didesnė srovė tampa įmanoma todėl, kad cinkas čia naudojamas ne stiklo, o miltelių pavidalu, turinčiais didesnį sąlyčio plotą su elektrolitu. Kalio hidroksidas pastos pavidalu naudojamas kaip elektrolitas.
Dėl šio tipo galvaninių elementų sugebėjimo ilgą laiką tiekti didelę srovę (iki 1 A), šiuo metu dažniausiai naudojamos šarminės baterijos.
Elektriniuose žaisluose, nešiojamojoje medicinos įrangoje, elektroniniuose prietaisuose, fotoaparatuose visur naudojamos šarminės baterijos. Jie tarnauja 1,5 karto ilgiau nei fiziologinis tirpalas, jei iškrova yra silpna. Diagramoje parodytos iškrovos kreivės esant skirtingoms srovėms, kad būtų galima palyginti su druskos akumuliatoriumi (grafikas buvo pateiktas aukščiau) 4, 10, 20 ir 40 valandų.
Ličio baterijos
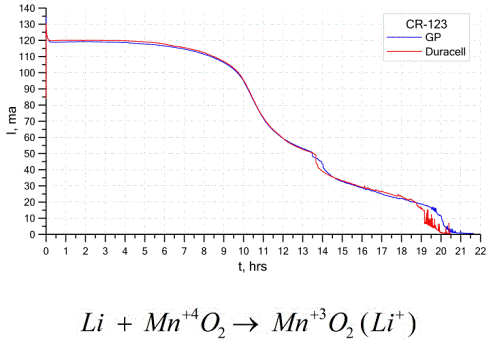
Kitas gana paplitęs galvaninių elementų tipas yra ličio baterijos - vienkartinės neperkraunamos galvaninės ląstelės, kuriose kaip anodas naudojamas ličio ar jo junginių pavidalas. Naudojant šarminį metalą, jie turi didelį potencialo skirtumą.

Ličio elemento katodas ir elektrolitas gali būti labai skirtingi, todėl terminas „ličio elementas“ sujungia ląstelių grupę su ta pačia anodo medžiaga.Pavyzdžiui, kaip katodą galima naudoti mangano dioksidą, anglies monofluoridą, piritą, tionilo chloridą ir kt.
Ličio baterijos iš kitų baterijų išsiskiria dideliu veikimo laiku ir didelėmis sąnaudomis. Priklausomai nuo pasirinkto dydžio ir naudojamų cheminių medžiagų, ličio akumuliatoriaus įtampa gali būti nuo 1,5 V (suderinama su šarminėmis baterijomis) iki 3,7 V.
Šios baterijos pasižymi didžiausia talpa, tenkančia masei, ir ilgą jų galiojimo laiką. Ličio elementai yra plačiai naudojami šiuolaikinėje nešiojamojoje elektroninėje įrangoje: laikrodžių maitinimui kompiuterių pagrindinėse plokštėse, nešiojamų medicinos prietaisų, laikrodžių, skaičiuoklių, fotoaparatų ir kt. Maitinimui.
Aukščiau pateiktoje diagramoje parodytos dviejų populiarių gamintojų dviejų ličio baterijų iškrovos kreivės. Pradinė srovė buvo 120 mA (vienam rezistoriui - maždaug 24 omų).
Taip pat žiūrėkite: Šiuolaikiškos įkraunamos baterijos - privalumai ir trūkumai
Taip pat žiūrėkite tinklalapyje bgv.electricianexp.com
: