Kategorijos: Pradedantieji elektrikai, Pramonės elektrikas
Peržiūrų skaičius: 37528
Straipsnio komentarai: 0
Praktinis elektrolizės pritaikymas
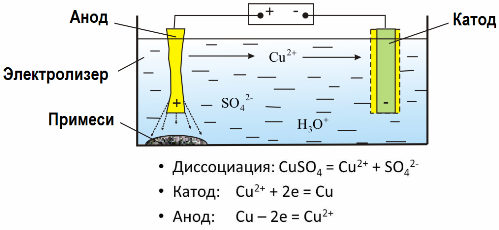
Kai elektros srovė praeina pro elektrolito tirpalą ar tirpiklį, ant elektrodų išsiskiria ištirpę elektrodai ar kitos medžiagos, kurios yra antrinių reakcijų į elektrodus produktai. Šis fizikinis ir cheminis procesas vadinamas elektrolize.
Elektrolizės esmė
Elektrodų sukurtame elektriniame lauke jonai, esantys laidžiame skystyje, juda tam tikru tvarka. Neigiamas elektrodas yra katodas, teigiamas - anodas.
Neigiami jonai, vadinami anijonais (hidroksilo grupės jonai ir rūgščių liekanos), sklinda prie anodo, o teigiami jonai, vadinami katijonais (vandenilio, metalo, amonio jonai ir kt.), Skrieja į katodą.
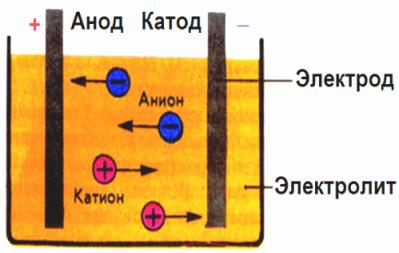
Elektroduose vyksta oksidacijos-redukcijos procesas: dalelių (atomų, molekulių, katijonų) elektrocheminis redukcija vyksta prie katodo, o dalelių (atomų, molekulių, anijonų) elektrocheminė oksidacija vyksta prie anodo. Disociacijos reakcijos elektrolite yra pirminės reakcijos, o reakcijos, vykstančios tiesiai prie elektrodų, vadinamos antrinėmis.
Faradėjaus elektrolizės dėsniai
Elektrolizės reakcijų atskyrimas į pirminius ir antrinius padėjo Michaelui Faradėjusui nustatyti elektrolizės dėsnius:
-
Pirmasis Faradėjaus elektrolizės dėsnis: cheminės medžiagos masė, nusodinta ant elektrodo elektrolizės metu, yra tiesiogiai proporcinga į šį elektrodą perduotos elektros energijos kiekiui. Elektros kiekiu laikomas elektros krūvis, paprastai matuojamas pakabučiais.
-
Antrasis Faradėjaus elektrolizės dėsnis: tam tikram elektros energijos kiekiui (elektros krūviui) ant elektrodo nusėdęs cheminio elemento masė yra tiesiogiai proporcinga ekvivalento elemento masei. Lygiavertė medžiagos masė yra jos molinė masė, padalyta iš sveikojo skaičiaus, atsižvelgiant į cheminę reakciją, kurioje dalyvauja cheminė medžiaga.
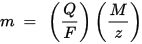
m yra ant elektrodo nusėdusios medžiagos masė, Q yra visas medžiagą einantis elektros krūvis F = 96,485,33 (83) C mol - 1 yra Faradėjaus konstanta, M yra medžiagos molinė masė (pvz., vandens molinė masė H2O = 18 g). / mol), z yra medžiagos jonų valentinis skaičius (elektronų skaičius viename jone).
Atkreipkite dėmesį, kad M / z yra lygiavertė nusodintos medžiagos masė. Pirmajam Faradėjaus dėsniui M, F ir z yra konstantos, todėl kuo didesnė Q reikšmė, tuo didesnė m reikšmė. Antrajame Faradėjaus dėsnyje Q, F ir z yra konstantos, todėl kuo didesnė M / z vertė (ekvivalentinė masė), tuo didesnė m vertė.
Elektrolizė šiandien plačiai naudojama pramonėje ir technologijose. Pavyzdžiui, elektrolizė yra vienas iš efektyviausių vandenilio, vandenilio peroksido, mangano dioksido, aliuminio, natrio, magnio, kalcio ir kitų medžiagų pramoninės gamybos būdų. Elektrolizė naudojama nuotekoms valyti, galvanizuojant, galvanizuojant ir galiausiai cheminių srovių šaltiniuose. Bet visų pirma pirmiausia.
Iš rūdų gaunami gryni metalai elektrolizės būdu
Elektrolizės dėka daugelis metalų yra išgaunami iš rūdų ir toliau perdirbami. Taigi, kai rūda ar prisodrinta rūdos koncentratas yra apdorojamas reagentais, metalas patenka į tirpalą, o, atlikus elektroekstrahavimą, metalas izoliuojamas iš tirpalo. Tuo pačiu metu katode išsiskiria grynas metalas. Tokiu būdu gaukite cinko, vario, kadmio.
Metalai apdorojami elektriniu būdu, kad būtų pašalintos priemaišos ir konvertuojami esantys nešvarumai į formą, patogią tolesniam perdirbimui. Valomas metalas yra liejamas plokštelių pavidalu, o šios plokštės naudojamos kaip anodai elektrolizės metu.
Kai srovė praeina, anodo metalas ištirpsta, katijonų pavidalu patenka į tirpalą, tada katijonai išleidžiami prie katodo ir sudaro gryno metalo nuosėdas. Anodo priemaišos netirpsta - jie nusėda su anodo suspensija arba patenka į elektrolitą, iš kur jie nuolat arba periodiškai pašalinami.
Apsvarstykite kaip pavyzdį vario elektrinis rafinavimas. Pagrindinis tirpalo komponentas - vario sulfatas - dažniausia ir pigiausia šio metalo druska. Tirpalo elektrinis laidumas yra mažas. Norėdami jį padidinti, į elektrolitą pridedama sieros rūgšties.
Be to, į tirpalą įpilama nedidelių priedų kiekių, kad būtų lengviau susidaryti kompaktiškoms metalo nuosėdoms. Paprastai varis, nikelis, švinas, alavas, sidabras ir auksas rafinuojami elektrolitiškai.
Elektrolizės nuotekų valymas
Nuotekų valymui naudojama elektrolizė (elektrokoaguliacijos, elektroekstrahavimo ir elektroflotacinio proceso). Elektrocheminis valymo būdas yra vienas iš dažniausiai naudojamų. Elektrolizei naudojami netirpūs anodai (magnetitas, švino oksidas, grafitas, manganas, kurie nusėda ant titano pagrindo) arba tirpūs (aliuminis, geležis).
Šis metodas naudojamas išskirti toksines organines ir neorganines medžiagas iš vandens. Pvz., Vario vamzdžiai valomi masto sieros rūgšties tirpalu, o pramoninės nuotekos turi būti valomos elektrolizės būdu netirpiu anodu. Vardas išleidžiamas prie katodo, kuris vėl gali būti naudojamas toje pačioje įmonėje.
Šarminės nuotekos išvalomos elektrolizės būdu iš cianido junginių. Norint pagreitinti cianidų oksidaciją, padidinti elektros laidumą ir taupyti energiją, vandenyje naudojamas priedas natrio chlorido pavidalu.
Elektrolizė atliekama naudojant grafito anodą ir plieninį katodą. Cianidai sunaikinami elektrocheminės oksidacijos metu ir chloras, kuris išsiskiria ant anodo. Tokio valymo efektyvumas yra beveik 100%.
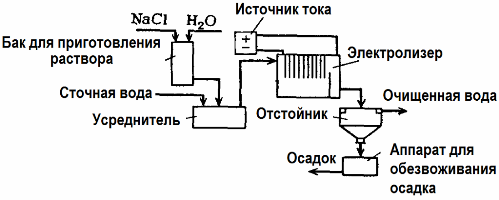
Be tiesioginio elektrocheminio valymo, jis gali būti įtrauktas į elektrolizės procesą krešėjimas. Išskyrus druskų pridėjimą, elektrolizė atliekama tirpiais aliuminio arba geležies anodais. Tada sunaikinami ne tik ant anodo esantys teršalai, bet ir pats anodas ištirpsta. Susidaro aktyvūs disperguoti junginiai, kurie koaguliuoja (tirština) koloidinius dispersinius teršalus.
Šis metodas yra efektyvus riebalų, naftos produktų, dažų, aliejaus, radioaktyviųjų medžiagų ir kt. Nuotekoms valyti. Jis vadinamas elektrokoaguliacija.
Galvanizacija
Galvanizacija yra tam tikrų metalų elektrolitinis nusodinimas, siekiant apsaugoti gaminius nuo korozijos ir suteikti jiems estetinę išvaizdą (danga padengta chromu, nikliu, sidabru, auksu, platina ir kt.). Daiktas kruopščiai išvalomas, nuriebalinamas ir naudojamas kaip katodas elektrolitinėje vonioje, kurioje pilamas metalo druskos tirpalas, su kuriuo būtina padengti gaminį.
Anodui naudojama to paties metalo plokštė. Paprastai naudojama anodo plokščių pora, o galvanizuojamas objektas dedamas tarp jų.
Elektroformavimas
Galvanizacija - metalo nusodinimas ant skirtingų kūnų paviršiaus, kad būtų atkurtos jų formos: liejimo formos, skulptūros, spausdintos klišos ir kt.

Galvaninis metalo nusodinimas ant objekto paviršiaus yra įmanomas tik tada, kai šis paviršius arba visas objektas yra elektros srovės laidininkas, todėl modeliams ar formoms patartina naudoti metalus. Šiam tikslui tinkamiausi yra lydieji metalai: švinas, alavas, lydmetaliai, medžio lydinys.
Šie metalai yra minkšti, lengvai apdirbami metalo apdirbimo įrankiais, yra gerai išgraviruoti ir lieti. Sukūrus galvaninį sluoksnį ir apdailai, liejamasis metalas smirdi nuo gatavo produkto.
Tačiau didžiausias modelių gamybos galimybes vis dar atspindi dielektrinės medžiagos. Norint metalizuoti tokius modelius, būtina nurodyti jų paviršiaus laidumą. Galiausiai sėkmė ar nesėkmė daugiausia priklauso nuo laidžiojo sluoksnio kokybės. Šis sluoksnis gali būti taikomas vienu iš trijų būdų.
Labiausiai paplitęs būdas yra grafitizavimas, jis tinka plastilino ir kitų medžiagų, leidžiančių malti grafitą ant paviršiaus, modeliams.
Kitas triukas yra bronzavimas, metodas yra tinkamas palyginti sudėtingos formos modeliams, skirtingoms medžiagoms, tačiau dėl bronzos sluoksnio storio mažų dalių perdavimas yra šiek tiek iškreiptas.
Ir pagaliau sidabrinimastinkamas visais atvejais, bet ypač būtinas trapiems modeliams su labai sudėtinga forma - augalams, vabzdžiams ir kt.
Cheminių srovių šaltiniai
Elektrolizė taip pat yra pagrindinis procesas, dėl kurio veikia pažangiausi cheminių srovių šaltiniai, tokie kaip baterijos ir akumuliatoriai. Su elektrolitu liečiasi du elektrodai.
Tarp elektrodų yra nustatytas potencialo skirtumas - elektromotorinė jėga, atitinkanti laisvą redokso reakcijos energiją. Norėdami gauti daugiau informacijos, žiūrėkite čia: Cheminiai elektros srovės šaltiniai
Citrinų baterija (paspauskite ant paveikslėlio, kad padidintumėte)
Cheminių srovės šaltinių veikimas grindžiamas erdvėje atskirtų procesų, turinčių uždarą išorinę grandinę, atsiradimu: neigiamame anode reduktorius oksiduojasi, susidarę laisvieji elektronai praeina per išorinę grandinę į teigiamą katodą, sukurdami iškrovos srovę, kur jie dalyvauja oksidacijos redukcijos reakcijoje. Taigi neigiamai įkrautų elektronų srautas išilgai išorinės grandinės eina nuo anodo iki katodo, tai yra nuo neigiamo elektrodo į teigiamą.
Taip pat žiūrėkite tinklalapyje bgv.electricianexp.com
: