kategória: Kiemelt cikkek » Kezdő villanyszerelők
Megtekintések száma: 36288
Megjegyzések a cikkhez: 1
Kémiai áramforrások: fő jellemzők
 Az emberiség több mint két évszázaddal különböző anyagok közötti kémiai reakciók energiáját használja egyenáram előállítására.
Az emberiség több mint két évszázaddal különböző anyagok közötti kémiai reakciók energiáját használja egyenáram előállítására.
Működési elv
Az oxidálószer és a redukálószer tulajdonságait mutató anyagok közötti redox reakciót elektronok felszabadulása kíséri, amelynek mozgása elektromos áramot képez. Annak érdekében, hogy energiáját felhasználni lehessen, meg kell teremteni az elektronok külső áramkörön történő áthaladásának feltételeit, különben hő hatására szabadul fel egy oxidálószer és redukálószer egyszerű keverékéből.
Ezért minden kémiai áramforrásnak két elektródja van:
-
az anód, amelyen az oxidáció történik;
-
egy anyag redukcióját végző katód.
Az elektródákat távolságból egy edénybe helyezik egy elektrolittel - egy anyaggal, amely a közeg ionokra történő disszociációjának folyamata miatt vezet elektromos áramot.
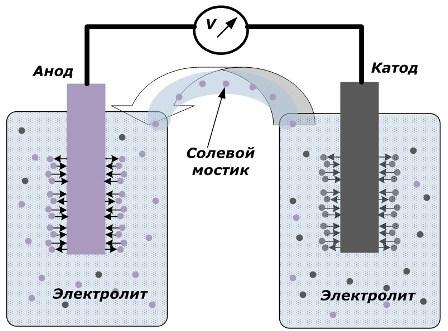
A kémiai energia elektromos energiává történő átalakításának alapelve
Az ábra azt mutatja, hogy az elektródákat külön edényekbe helyezik egy sóhíddal, amelyen keresztül az ionok a belső áramkör mentén mozognak. Ha a külső és a belső áramkörök nyitva vannak, az elektródokon két folyamat zajlik: az ionok átmennek az elektród fémétől az elektrolitra és az ionok átmennek az elektrolittól az elektródák kristályrácsához.
Ezeknek a folyamatoknak az áramlási sebessége azonos, és az ellenkező jelek feszültségpotenciáljai felhalmozódnak az egyes elektródákra. Ha sóhídon keresztül csatlakoznak és terhelést alkalmaznak, akkor áramkör lép fel. Belső áramot generál az ionok az elektródok közötti, az elektroliton és a sóhídon keresztüli mozgása. Az elektronok mozgása a külső áramkör mentén az anód és a katód közötti irányban.
Szinte minden redox reakciót villamosenergia-termelés kísér. Értéke azonban sok tényezőtől függ, beleértve a felhasznált vegyi anyagok mennyiségét és tömegét, az elektródok előállításához felhasznált anyagokat, például az elektrolitot, az ionkoncentrációt, a tervezést.
A modern kémiai áramforrásokban a legelterjedtebbek:
-
az anód (redukálószer) anyaga, cink (Zn), ólom (Pb), kadmium (Cd) és néhány más fémek;
-
a katód anyagához (oxidálószer) - ólom-oxid PbO2, mangán-oxid MnO2, nikkel-hidroxid NiOOH és mások;
-
savak, lúgok vagy sók oldatán alapuló elektrolitok.
Osztályozási módszerek
A kémiai energiaforrások egyik része újra felhasználható, a másik nem. Ezt az alapelvet veszik alapul osztályozásukban.
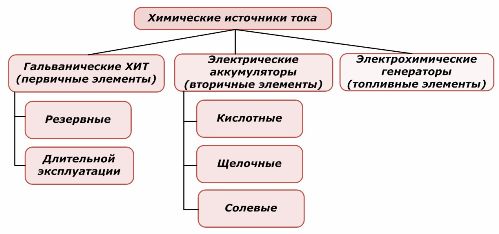
A kémiai elemek osztályozása
Elektromotoros erő galván celláka kialakítástól függően eléri az 1,2 ÷ 1,5 voltot. A nagy értékek elérése érdekében elemeket kombinálnak, sorba kapcsolva. Ha az elemeket párhuzamosan csatlakoztatják, az áram és az energia növekszik.
Általánosan elfogadott tény, hogy az elsődleges kémiai áramforrások nem támogatják az újratöltést, bár pontosabban ez a helyzet másképpen megfogalmazható: végrehajtása gazdasági szempontból nem megvalósítható.
A redundáns primer kémiai áramforrásokat olyan állapotban tárolják, amikor az elektrolit el van választva az elektródoktól. Ez kiküszöböli a redox reakció előfordulását és biztosítja az üzemkész állapotot. Nem kerülnek újra felhasználásra. A kémiai tartalék energiaforrások eltarthatósága 10–15 évre korlátozódik.
Az akkumulátorok sikeres feltöltése külső elektromos energia alkalmazásával történik. Ennek a tulajdonságnak köszönhetően másodlagos áramforrásoknak nevezik őket. Képesek kibírni több száz és ezer töltési és töltési ciklust.Az akkumulátor EMF-je 1,0 ÷ 1,5 V tartományban lehet. Elemeket is egyesítenek.
Az elektrokémiai generátorok a galvanikus cellák elvén működnek, de kívülről anyagot hordoznak az elektrokémiai reakció végrehajtására, és az összes felszabadult terméket eltávolítják az elektrolitból. Ez lehetővé teszi a folyamatos folyamat megszervezését.
A kémiai energiaforrások főbb jellemzői
1. A feszültség a nyitott kapcsok között
A kiviteltől függően egyetlen forrás csak bizonyos potenciálkülönbséget hozhat létre. Elektromos készülékekben történő használatra elemeikké vannak kombinálva.
2. Sajátos kapacitás
Egy bizonyos ideig (órákban) egy kémiai áramforrás korlátozott mennyiségű áramot képes generálni (amperben), amelyet a súly- vagy térfogat-egységnek tulajdonítanak.
3. Teljesítmény sűrűség
Ez egy kémiai áramforrás tömeg- vagy térfogata egységének azon képességét jellemzi, hogy a feszültség szorzata által generált energiát áramszilárdság szerint adja meg.
4. A művelet időtartama
Ezt a paramétert lejárati dátumnak is hívják.
5. Az önkisülési áramok értéke
Az elektrokémiai reakciók ezen oldalsó folyamatai az elemek aktív tömegének fogyasztásához vezetnek, korróziót okoznak és csökkentik a fajlagos kapacitást.
6. Termék ára
A tervezéstől, a felhasznált anyagokatól és számos egyéb tényezőtől függ.
A legjobb kémiai áramforrások azok, amelyeknél az első négy paraméter értéke magas, az önkisülés és a költség alacsony.
Az akkumulátor töltésének alapelvei
A másodlagos kémiai áramforrások között nagy népszerűségnek örvendenek. lítium-ion modellek, amelyeket széles körben használnak az elektronikus eszközök táplálására. LiMO2-ot (M Co, Ni, Mn) használnak a pozitív elektróda anyagaként, a grafitot pedig negatív elektródaként.
Töltéskor az alkalmazott külső energia lítium-ionjai felszabadulnak a katódfémből, áthaladnak az elektroliton, és behatolnak az ott felhalmozódó grafitrétegek közötti térbe.
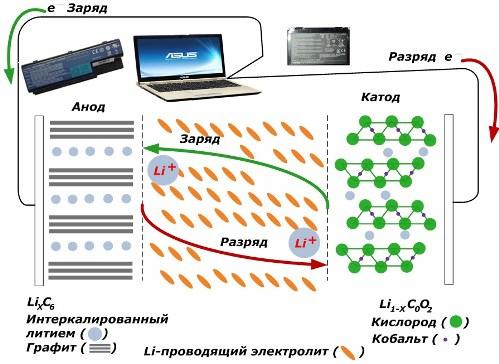
Amikor az energia töltő hiányzik, és a terhelés az elektródokhoz kapcsolódik, akkor az elektrolitban lévő lítium-ionok az ellenkező irányba mozognak.
Ha a töltést és a kisütést nem hajtják végre, akkor az akkumulátor energiáját nem fogyasztják, hanem tárolják. De mennyiségét a felhasznált anyagok tulajdonságai korlátozzák. Például lítium-ion akkumulátorokban a fajlagos elektromos kapacitás 130 ÷ 150 mAh / g. Ezt az anód anyag tulajdonságai korlátozzák. A grafit esetében a kapacitás körülbelül kétszer nagyobb.
A tudósok most keresik az akkumulátor kapacitásának növelésének lehetőségeit, és feltárják a lítium és a levegő oxigénje közötti kémiai reakció alkalmazásának lehetőségét. Ehhez a terveket levegő nélküli, nem felhasználandó katóddal fejlesztették ki, amelyet külön elemekben használnak. Ez a módszer akár tízszeresére is növelheti az energia sűrűségét.
A kémiai áramforrások működtetése ismereteket igényel az elektrotechnika alapjai, elektrokémia, anyagtudomány és szilárdtestfizika.
Lásd még az bgv.electricianexp.com oldalon
:
