kategória: Kiemelt cikkek » Kezdő villanyszerelők
Megtekintések száma: 70526
Megjegyzések a cikkhez: 0
Galváncellák - eszköz, működési elv, típusok és főbb jellemzők
A galvanikus elemek megjelenésének előfeltételei. Egy kis történelem. 1786-ban Luigi Aloisio Galvani, az orvostudomány olasz orvosprofesszora érdekes jelenséget fedezett fel: a rézhorgon felfüggesztett béka frissen nyitott holttestének hátsó lábainak izmai összehúzódtak, amikor a tudós acélszikkel megérintette őket. Galvani azonnal arra a következtetésre jutott, hogy ez az "állati elektromosság" megnyilvánulása.
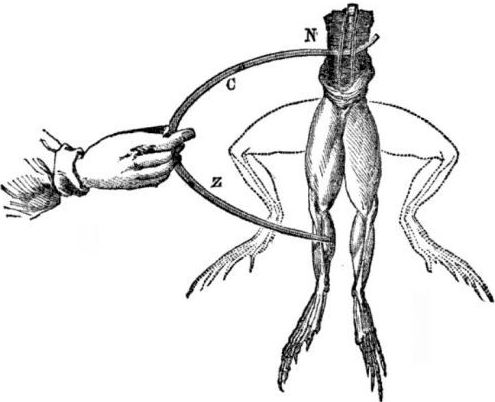
Galvani halála után kortárs Alessandro Volta, mint vegyész és fizikus, leírja és nyilvánosan bemutatja az elektromos áram előfordulásának reálisabb mechanizmusát, amikor a különböző fémek érintkezésbe kerülnek.
A Volta egy kísérleti sorozat után egyértelmű következtetésre jut, hogy az áram akkor jelenik meg az áramkörben, ha folyadékba helyezett különböző fémek két vezetője van benne, és ez egyáltalán nem „állati áram”, ahogy Galvani gondolta. A béka lábai megrándulása a különféle fémek (rézhorgok és acélszike) érintkezéséből adódó áram hatása volt.
A Volta ugyanazokat a jelenségeket fogja mutatni, mint amilyeneket Galvani mutatott egy elhullott békon, de egy teljesen élettelen otthoni elektrométeren, és 1800-ban pontos magyarázatot ad az aktuálisról: “a második osztályú vezető (folyadék) közepén van, és érintkezésben van két különböző osztályú első osztályú vezetővel. fémek ... Ennek eredményeként egy vagy másik irányba áramlik az áram. "

Az első kísérletek egyikében a Volta két lemezt - cinket és rézet - egy üveg edénybe engedt le és huzallal összekapcsolta. Ezután a cinklemez feloldódni kezdett, és gázbuborékok képződtek a réz acélon. Volta javasolta és bebizonyította, hogy az elektromos áram átvezet a vezetéken.
Így találták ki a "Volta elem" - az első galvanikus cella. A kényelem kedvéért Volta egy függőleges henger (oszlop) alakját adott neki, amely összekapcsolt cink-, réz- és savval átitatott gyűrűkből áll. A fél méter magas volt volt pólus az emberekre érzékeny feszültséget hozott létre.
A kutatás kezdete óta Luigi Galvani, a név írta kémiai áramforrás megőrizte emlékét a nevében.
Galván cella Elektromos áram kémiai forrása, amely két fémek és / vagy oxidjaik kölcsönhatásán alapul egy elektrolitban, és ez egy elektromos áram megjelenését eredményezi egy zárt körben. Így a galván cellákban a kémiai energiát elektromos energiává alakítják.
Cellák ma

A cellákat ma akkumulátornak nevezzük. Három típusú elem széles körben elterjedt: sós (száraz), lúgos (ezeket alkálinak, angolul fordítva "alkáli" -nak is nevezzük - "alkáli") és lítiumot. Munkájuk elve megegyezik a Volta által 1800-ban leírtakkal: két fém kölcsönhatásba lépnek az elektroliton keresztül, és egy külső zárt körben elektromos áram merül fel.
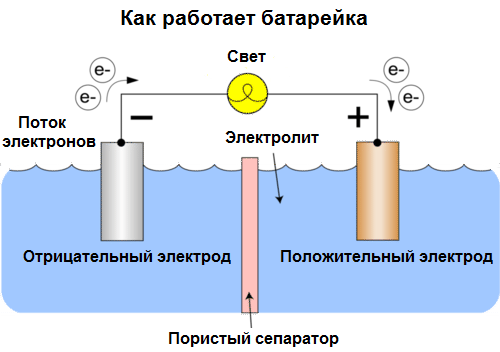
Az akkumulátor feszültsége a használt fémektől és az "elem" celláinak számától függ. Az akkumulátorok, az akkumulátorokkal ellentétben, nem képesek visszaállítani tulajdonságaikat, mivel közvetlenül a kémiai energiát, azaz az akkumulátort képező reagensek (redukálószer és oxidálószer) energiáját elektromos energiává alakítják.
Az akkumulátorban lévő reagenseket annak működése közben elfogyasztják, az áram fokozatosan csökken, ezért a forrás működése akkor fejeződik be, amikor a reagensek teljesen reagálnak.
Az alkáli- és sóelemeket (elemeket) széles körben használják különféle elektronikai eszközök, rádióberendezések, játékok és lítium leggyakrabban megtalálható hordozható orvostechnikai eszközökben, például vércukorszintmérőkben vagy digitális technológiában, például kamerákban.

Só akkumulátorok
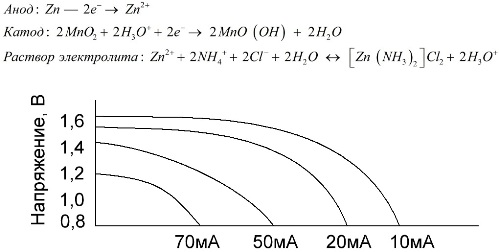
A mangán-cink cellák, amelyeket sóakkumulátoroknak neveznek, „száraz” galván cellák, amelyek belsejében nincs folyékony elektrolit oldat.
A cink-elektróda (+) egy csésze alakú katód, az anód pedig mangán-dioxid és grafit poros keveréke. Az áram egy grafitrúdon keresztül áramlik. Elektrolitként pasztát használnak ammónium-klorid oldatából keményítő vagy liszt hozzáadásával, hogy megvastagodjon, hogy semmi ne folyjon.
Az akkumulátorgyártók általában nem adják meg a sóelemek pontos összetételét, azonban a sóelemek a legolcsóbbak, általában olyan készülékekben használják, ahol az energiafogyasztás rendkívül alacsony: órákban, távirányítókon, elektronikus hőmérőkben stb.

A "névleges kapacitás" fogalmát ritkán használják a mangán-cink elemek elemzésére, mivel azok kapacitása nagymértékben függ az üzemi körülményektől és körülményektől. Ezen elemek fő hátrányai a jelentős feszültségcsökkentési sebesség a kisülés során és a kimeneti kapacitás jelentős csökkenése a kisülési áram növekedésével. A végső kisülési feszültséget a terheléstől függően a 0,7-1,0 V tartományba kell beállítani.
Nem csak a kisülési áram nagysága, hanem a terhelés ütemezése is fontos. A nagy és közepes áramú szakaszos kisülés esetén az akkumulátorok teljesítménye jelentősen növekszik a folyamatos működéshez képest. Kicsi kisülési áramerősséggel és néhány hónapos megszakításokkal azonban kapacitásuk csökkenhet az önkisülés következtében.
A fenti ábra egy átlagos sótartalmú akkumulátor kisülési görbéit mutatja 4, 10, 20 és 40 órán keresztül, összehasonlítva egy lúgos elemmel, amelyet később tárgyalunk.
Lúgos (alkáli) elemek
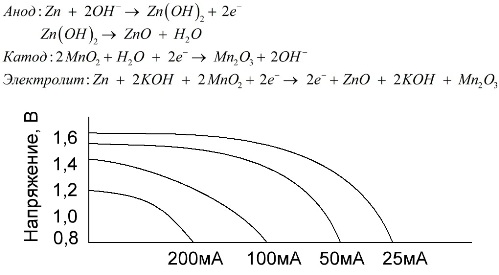
Az alkáli elem egy mangán-cink galván elem, amelyben mangán-dioxidot használnak katódként, porított cinket használnak anódként, és alkálifém oldatot használnak elektrolitként, általában kálium-hidroxid paszta formájában.
Ezeknek az akkumulátoroknak számos előnye van (különösen jelentősen nagyobb kapacitás, jobb teljesítmény alacsony hőmérsékleten és nagy terhelési áramok mellett).

Az alkáli elemek, a sóoldattal összehasonlítva, hosszabb ideig több áramot szolgáltathatnak. Nagyobb áramerősség válik lehetővé, mivel a cinket itt nem üveg formájában, hanem por formájában használják, amelynek nagyobb érintkezési területe van az elektrolittal. Elektrolitként paszta formájában lévő kálium-hidroxidot használnak.
Ennek köszönhetően, hogy az ilyen típusú galvanikus cellák képesek hosszú ideig jelentős (legfeljebb 1 A) áramot szolgáltatni, az alkáli elemek általában a leggyakoribbak.
Az elektromos játékokban, a hordozható orvosi berendezésekben, az elektronikus eszközökben, a kamerákban mindenütt alkalikus elemeket használnak. 1,5-szer hosszabb ideig szolgálnak, mint a sóoldat, ha kisülési áram alacsony. A grafikon ábrázolja a kisülési görbéket különböző áramokon, összehasonlítva egy sóakkumulátorral (a grafikon a fenti volt) 4, 10, 20 és 40 órán keresztül.
Lítium elemek
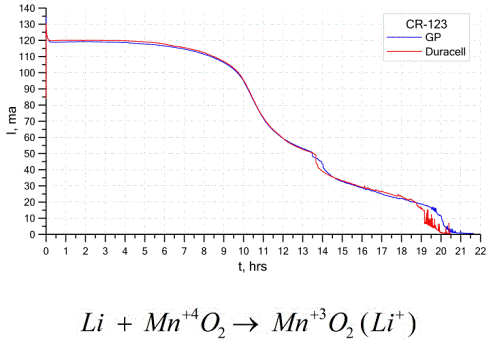
Egy másik meglehetősen általános galváncellátípus a lítium-elemek - egyszeres nem újratölthető galvanikus cellák, amelyekben lítiumot vagy annak vegyületeit használják anódként. Az alkálifém használata miatt nagy a potenciálkülönbségük.

A lítiumcellák katódja és elektrolitja nagyon eltérő lehet, tehát a „lítiumcellás” kifejezés cellák egy csoportját egyesíti ugyanazon anód anyaggal.Katódként például mangán-dioxid, szén-monofluorid, pirit, tionil-klorid stb. Alkalmazhatók.
A lítium akkumulátorokat megkülönbözteti a többi akkumulátoroktól a nagy üzemidő és a magas költségek. A választott mérettől és az alkalmazott kémiai anyagokatól függően a lítium akkumulátor 1,5 V-os (alkáli elemekkel kompatibilis) és 3,7 V közötti feszültséget képes előállítani.
Ezeknek az akkumulátoroknak a legnagyobb a tömeg egységnyi kapacitása és hosszú eltarthatósági ideje. A lítium cellákat széles körben használják a modern hordozható elektronikus berendezésekben: órák táplálására számítógépes alaplapokon, hordozható orvostechnikai eszközök, órák, számológépek táplálására, fényképészeti berendezésekben stb.
A fenti ábra két népszerű gyártó két lítium akkumulátorának kisülési görbéit mutatja. A kezdeti áram 120 mA volt (ellenállásonként körülbelül 24 Ohm).
Lásd még: Modern újratölthető akkumulátorok - előnyei és hátrányai
Lásd még az bgv.electricianexp.com oldalon
: