kategória: Kezdő villanyszerelők, Ipari villanyszerelő
Megtekintések száma: 37528
Megjegyzések a cikkhez: 0
Az elektrolízis gyakorlati alkalmazása
Amikor egy elektromos áram áthalad az elektrolit oldatán vagy olvadékán, az oldott anyagok vagy más anyagok, amelyek az elektródokon a másodlagos reakció eredményeként keletkeznek, az elektródokon szabadulnak fel. Ezt a fizikai-kémiai folyamatot elektrolízisnek nevezik.
Az elektrolízis lényege
Az elektródok által létrehozott elektromos mezőben a vezető folyadékban lévő ionok rendezett mozgásban vannak. A negatív elektród a katód, a pozitív az anód.
Anionoknak nevezett negatív ionok (a hidroxilcsoport ionjai és savmaradványok) az anódhoz rohannak, a kationoknak nevezett pozitív ionok (hidrogén, fém, ammónium-ionok stb.) Pedig a katódhoz rohannak.
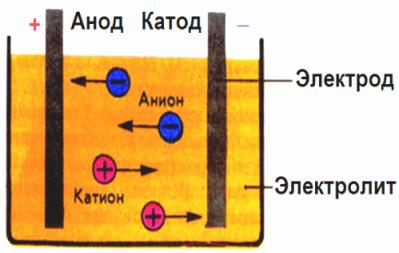
Az elektródokon oxidációs-redukciós folyamat zajlik: a katódnál a részecskék (atomok, molekulák, kationok) elektrokémiai redukciója, az anódon pedig a részecskék (atomok, molekulák, anionok) elektrokémiai oxidációja következik be. Az elektrolitban a disszociációs reakciók primer reakciók, és azokat a reakciókat, amelyek közvetlenül az elektródokon zajlanak, másodlagosnak nevezzük.
A Faraday elektrolízis törvényei
Az elektrolízis reakcióinak szétválasztása primer és szekunderre segített Michael Faradaynak az elektrolízis törvényeinek meghatározásában:
-
A Faraday elektrolízis első törvénye: az elektródon az elektrolízis során lerakódott anyag tömege közvetlenül arányos az ehhez az elektródra továbbított villamos energia mennyiségével. Az árammennyiség alatt olyan villamos töltést értünk, amelyet általában medálokban mérnek.
-
A Faraday elektrolízisének második törvénye: egy adott mennyiségű villamosenergia (elektromos töltés) esetén az elektródra lerakódott kémiai elem tömege közvetlenül arányos az elem ekvivalens tömegével. Az anyag ekvivalens tömege a molekulatömege egész számmal osztva, az anyag kémiai reakciójától függően.
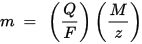
m az elektródra lerakódott anyag tömege, Q az anyagon áthaladó teljes elektromos töltés F = 96,485,33 (83) C mol - 1 a Faraday-állandó, M az anyag móltömege (például a víz moláris tömege H2O = 18 g) / mol), z az anyag ionjainak valenciaszáma (az elektronok száma iononként).
Vegye figyelembe, hogy az M / z a kicsapódott anyag ekvivalens tömege. Az első Faraday-törvényben M, F és z konstans, tehát minél nagyobb Q érték, annál nagyobb m értéke. A második Faraday-törvényben Q, F és z konstans, tehát minél nagyobb az M / z (ekvivalens tömeg) értéke, annál nagyobb az m értéke.
Az elektrolízist manapság széles körben használják az iparban és a technológiában. Például az elektrolízis az egyik leghatékonyabb módszer hidrogén, hidrogén-peroxid, mangán-dioxid, alumínium, nátrium, magnézium, kalcium és más anyagok ipari előállítására. Az elektrolízist szennyvíz kezelésére, galvanizáláshoz, galvanizáláshoz és végül kémiai áramforrásokhoz használják. De az első dolgok először.
Tiszta fémek nyerése ércből elektrolízissel
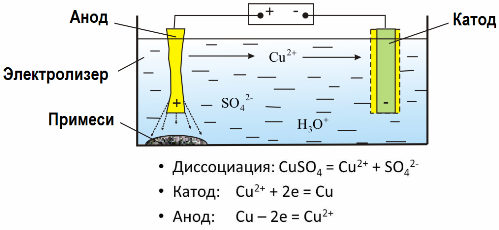
Az elektrolízisnek köszönhetően sok fémet extrahálnak az ércekből és további feldolgozásnak vetik alá őket. Tehát, ha érc vagy dúsított érc - koncentrátum - reagensekkel kezelik, a fém átjut az oldatba, majd a fémot elektroextrakcióval extrahálják az oldatból. A tiszta fém ugyanakkor szabadul fel a katódon. Ilyen módon kapható cink, réz és kadmium.
A fémeket elektromos finomításnak vetik alá a szennyeződések kiküszöbölése és a benne lévő szennyeződések további feldolgozásra alkalmas formává történő átalakítása céljából. A tisztítandó fémet lemezek formájában öntik, és ezeket a lemezeket anódként használják az elektrolízis során.
Az áram áthaladásakor az anód féme feloldódik, kationok formájában jut az oldatba, majd a kationokat a katódnál ürítik, és tiszta fém csapadékot képeznek. Az anód szennyeződései nem oldódnak fel - az anód-szuszpenzióval kicsapódnak vagy átjutnak az elektrolitba, ahonnan folyamatosan vagy időszakosan eltávolítják őket.
Vegyünk példát réz elektromos finomítás. Az oldat fő alkotóeleme - réz-szulfát - ennek a fémnek a leggyakoribb és legolcsóbb sója. Az oldat elektromos vezetőképessége alacsony. Ennek növelése érdekében kénsavat adnak az elektrolithoz.
Ezenkívül kis mennyiségű adalékot vezetünk az oldatba, hogy megkönnyítsük a kompakt fém csapadék képződését. Általában a réz, nikkel, ólom, ón, ezüst és arany elektrolitikus finomításnak vannak kitéve.
Elektrolízis szennyvízkezelés
Az elektrolízist a szennyvízkezelésben (elektrokoagulációs, elektroextrakciós és elektroflotációs folyamatok) használják. Az elektrokémiai tisztítási módszer az egyik leggyakrabban alkalmazott módszer. Az elektrolízishez oldhatatlan anódokat (magnetit, ólom-oxid, grafit, mangán, amelyek titán alapon helyezkednek el) vagy oldható (alumínium, vas) anódokat használnak.
Ezt a módszert mérgező szerves és szervetlen anyagok vízből történő izolálására használják. Például a rézcsöveket méretarányosan kénsav oldattal tisztítják, majd az ipari szennyvizet elektrolízissel, oldhatatlan anóddal kell tisztítani. A réz a katódnál szabadul fel, amelyet ugyanabban a vállalkozásban is lehet használni.
Az alkáli szennyvíz elektrolízissel tisztítható a cianidvegyületekből. A cianidok oxidációjának felgyorsítása, az elektromos vezetőképesség növelése és az energiamegtakarítás érdekében vízben nátrium-klorid formájában alkalmazott adalékanyagot használnak.
Az elektrolízist grafit anóddal és acél katóddal végezzük. A cianidok az elektrokémiai oxidáció során elpusztulnak, és az anódon felszabaduló klór. Az ilyen tisztítás hatékonysága közel 100%.
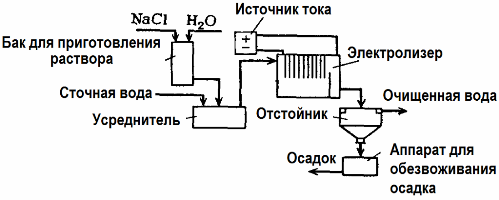
A közvetlen elektrokémiai tisztításon kívül bevonható az elektrolízisbe alvadás. A sók hozzáadása nélkül az elektrolízist oldható alumínium vagy vas anódokkal hajtják végre. Ekkor nem csak az anód szennyeződései pusztulnak el, hanem maga az anód is feloldódik. Aktív diszpergált vegyületek képződnek, amelyek koagulálják (megvastagítják) kolloid diszpergált szennyező anyagokat.
Ez a módszer hatékony zsírok, olajtermékek, színezékek, olajok, radioaktív anyagok stb. Szennyvízének kezelésére. Elektrokoaguilációnak nevezzük.
galvanizálás
Az galvanizálás az egyes fémek elektrolitikus lerakódása a termékek korrózió elleni védelme és megfelelő esztétikai megjelenése érdekében (krómmal, nikkeltel, ezüsttel, aranygal, platinával stb.). Az anyagot alaposan megtisztítják, zsírtalanítják és katódként használják egy elektrolitikus fürdőben, amelybe a fém sóoldatát öntik, amellyel a terméket be kell vonni.
Az anódhoz ugyanabból a fémlemezből készül. Általános szabály, hogy egy anódlapot használnak, és a horganyzandó tárgy közöttük vannak.
galvanoplastics
Galvanizálás - fém lerakódása a különféle testek felületére alakjaik reprodukálására: öntőformák alkatrészek öntésére, szobrok, nyomtatott klisék stb.

A fém galván lerakódása egy tárgy felületén csak akkor lehetséges, ha ez a felület vagy az egész tárgy elektromos áramvezető, ezért modellek vagy alakok készítéséhez tanácsos fémeket használni. Az olvasztható fémek a legalkalmasabbak erre a célra: ólom, ón, forrasztók, fa ötvözet.
Ezek a fémek lágyak, könnyen megmunkálhatók fémmegmunkáló szerszámokkal, jól bevésve és öntve. A galván réteg felépítése és a befejezés után az öntöttfémet a késztermékből megolvasztják.
A modellek gyártásának legnagyobb lehetőségeit azonban továbbra is a dielektromos anyagok képviselik. Az ilyen modellek fémezéséhez meg kell adni a felületük elektromos vezetőképességét. A siker vagy kudarc végső soron elsősorban a vezető réteg minőségétől függ. Ezt a réteget háromféle módszer egyikével lehet felvinni.
A leggyakoribb módszer grafitirovanie, gyurma és más anyagok olyan modelljeire alkalmas, amelyek lehetővé teszik a grafit köszörülését a felületen.
A következő trükk az barnító, a módszer viszonylag összetett alakú modellek esetén jó, különféle anyagok esetében, azonban a bronzréteg vastagsága miatt a kis alkatrészek átvitele kissé torzul.
És végül ezüstösminden esetben alkalmas, de különösen elengedhetetlen egy nagyon összetett alakú törékeny modellekhez - növények, rovarok stb.
Kémiai áramforrások
Az elektrolízis szintén a fő folyamat, amelynek eredményeként a legfejlettebb kémiai áramforrások, például elemek és akkumulátorok működnek. Két elektród van kapcsolatban az elektrolittal.
Az elektródok között meghatározzuk egy potenciálkülönbséget - egy elektromotoros erő, amely megfelel a redox reakció szabad energiájának. További részletek itt: Az elektromos áram kémiai forrásai
Citrom akkumulátor (kattintson a képre a nagyításhoz)
A kémiai áramforrások működése a zárt külső áramkörrel térben elválasztott folyamatok előfordulásán alapul: a negatív anódon a redukálószer oxidálódik, a képződött szabad elektronok a külső áramkörön átjutnak a pozitív katódhoz, kisülési áramot hozva létre, ahol részt vesznek az oxidációs redukciós reakcióban. Így a negatív töltésű elektronok áramlása a külső áramkör mentén az anódtól a katódig, azaz a negatív elektródtól a pozitívig megy keresztül.
Lásd még az bgv.electricianexp.com oldalon
: