Categorías: Artículos destacados » Electricistas novatos
Cantidad de vistas: 36288
Comentarios sobre el artículo: 1
Fuentes de corriente química: características principales
 Durante más de dos siglos, la humanidad ha estado utilizando la energía de las reacciones químicas entre varias sustancias para producir corriente continua.
Durante más de dos siglos, la humanidad ha estado utilizando la energía de las reacciones químicas entre varias sustancias para producir corriente continua.
Principio de funcionamiento
La reacción redox que ocurre entre sustancias con las propiedades de un agente oxidante y un agente reductor se acompaña de la liberación de electrones, cuyo movimiento forma una corriente eléctrica. Sin embargo, para usar su energía, es necesario crear condiciones para el paso de electrones a través de un circuito externo; de lo contrario, se libera por calor de una mezcla simple de un agente oxidante y un agente reductor.
Por lo tanto, todas las fuentes de corriente química tienen dos electrodos:
-
el ánodo en el que ocurre la oxidación;
-
cátodo, llevando a cabo la restauración de la sustancia.
Los electrodos a distancia se colocan en un recipiente con un electrolito, una sustancia que conduce corriente eléctrica debido a los procesos de disociación del medio en iones.
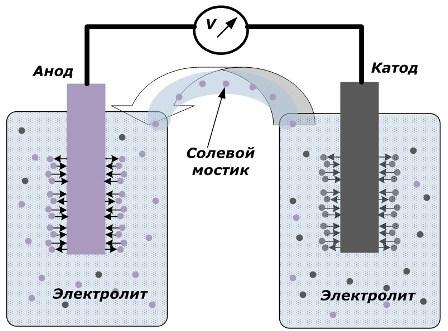
El principio de convertir la energía química en energía eléctrica.
La figura muestra que los electrodos se colocan en recipientes separados conectados por un puente de sal a través del cual se crea el movimiento de iones a lo largo del circuito interno. Cuando los circuitos externos e internos están abiertos, se producen dos procesos en los electrodos: la transición de iones del metal del electrodo al electrolito y la transición de iones del electrolito a la red cristalina de los electrodos.
Los caudales de estos procesos son los mismos y los potenciales de voltaje de signos opuestos se acumulan en cada electrodo. Si están conectados a través de un puente de sal y se aplica una carga, se producirá un circuito eléctrico. Se genera una corriente interna por el movimiento de iones entre los electrodos a través del electrolito y el puente de sal. El movimiento de electrones a lo largo del circuito externo en la dirección del ánodo al cátodo.
Casi todas las reacciones redox van acompañadas de generación de electricidad. Pero su valor depende de muchos factores, incluidos los volúmenes y las masas de los productos químicos utilizados, los materiales utilizados para fabricar los electrodos, como electrolitos, concentración de iones, diseño.
Los más utilizados en las fuentes modernas de corriente química son:
-
para el material del ánodo (agente reductor), zinc (Zn), plomo (Pb), cadmio (Cd) y algunos otros metales;
-
para el material del cátodo (oxidante): óxido de plomo PbO2, óxido de manganeso MnO2, hidróxido de níquel NiOOH y otros;
-
electrolitos a base de soluciones de ácidos, álcalis o sales.
Métodos de clasificación
Una parte de las fuentes de energía química puede reutilizarse, mientras que la otra no. Este principio se toma como base para su clasificación.
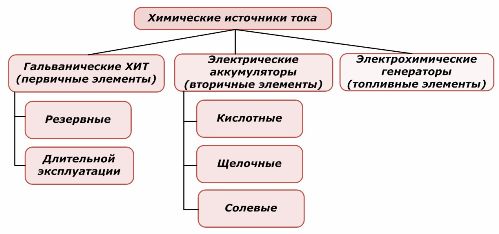
Clasificación de elementos químicos.
Fuerza electromotriz celdas galvánicas, dependiendo del diseño, alcanza 1.2 ÷ 1.5 voltios. Para obtener grandes valores, se combinan en baterías, conectando en serie. Cuando las baterías están conectadas en paralelo, la corriente y la potencia aumentan.
En general, se acepta que las fuentes de corriente químicas primarias no admiten la recarga, aunque más precisamente esta posición puede formularse de manera diferente: su implementación no es económicamente factible.
Las fuentes de corriente química primaria redundantes se almacenan en un estado donde el electrolito está aislado de los electrodos. Esto elimina la aparición de la reacción redox y asegura la preparación para la puesta en servicio. No se reutilizan. La vida útil de las fuentes de energía de respaldo químico está limitada a 10-15 años.
Las baterías se recargan con éxito mediante la aplicación de energía eléctrica externa. Debido a esta característica, se denominan fuentes de corriente secundarias. Son capaces de soportar cientos y miles de ciclos de carga y descarga.El EMF de la batería puede estar en el rango de 1.0 ÷ 1.5 voltios. También se combinan en baterías.
Los generadores electroquímicos funcionan según el principio de las células galvánicas, pero para llevar a cabo la reacción electroquímica, las sustancias provienen del exterior y todos los productos liberados se eliminan del electrolito. Esto le permite organizar un proceso continuo.
Características clave de rendimiento de las fuentes de energía química.
1. El voltaje a través de terminales abiertos
Dependiendo del diseño, una sola fuente puede crear solo una cierta diferencia potencial. Para su uso en dispositivos eléctricos, se combinan en baterías.
2. Capacidad específica
Durante cierto tiempo (en horas) una fuente de corriente química puede generar una cantidad limitada de corriente (en amperios), que se atribuyen a una unidad de peso o volumen.
3. Densidad de potencia
Caracteriza la capacidad de una unidad de peso o volumen de una fuente de corriente química para generar energía generada por el producto del voltaje por la intensidad de la corriente.
4. Duración de la operación.
Este parámetro también se llama fecha de vencimiento.
5. El valor de las corrientes de autodescarga
Estos procesos secundarios de reacciones electroquímicas conducen al consumo de la masa activa de los elementos, causan corrosión y reducen la capacidad específica.
6. Precio del producto
Depende del diseño, los materiales utilizados y una serie de otros factores.
Las mejores fuentes de corriente química son aquellas con valores altos de los primeros cuatro parámetros, y la autodescarga y el costo son bajos.
Principios de carga de la batería
Entre las fuentes de corriente químicas secundarias, están ganando gran popularidad. modelos de iones de litio, que se han utilizado ampliamente para alimentar dispositivos electrónicos. Utilizan LiMO2 (M Co, Ni, Mn) como material del electrodo positivo y grafito como electrodo negativo.
Cuando se cargan, los iones de litio de la energía externa aplicada se liberan del metal del cátodo, pasan a través del electrolito y penetran en el espacio entre las capas de grafito, acumulándose allí.
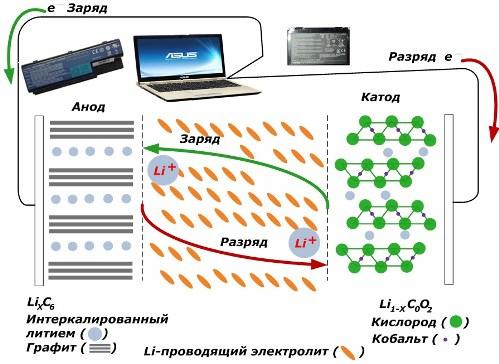
Cuando la energía cargador está ausente y la carga está conectada a los electrodos, luego los iones de litio en el electrolito se mueven en la dirección opuesta.
Si la carga y la descarga no se llevan a cabo, la energía de la batería no se consume, sino que se almacena. Pero su cantidad está limitada por las propiedades de los materiales utilizados. Por ejemplo, en las baterías de iones de litio, la capacidad eléctrica específica es de 130 ÷ 150 mAh / g. Está limitado por las propiedades del material del ánodo. Para el grafito, la capacidad es aproximadamente dos veces mayor.
Los científicos ahora están buscando formas de aumentar la capacidad de la batería, están explorando la posibilidad de utilizar una reacción química entre el litio y el oxígeno en el aire. Para hacer esto, los diseños se desarrollan con un cátodo de aire no desechable, que se usa en baterías separadas. Este método puede aumentar la densidad de energía hasta 10 veces.
El funcionamiento de las fuentes químicas actuales requiere conocimiento. fundamentos de la ingeniería eléctrica, electroquímica, ciencia de los materiales y física del estado sólido.
Ver también en bgv.electricianexp.com
:
