Categorías: Artículos destacados » Electricistas novatos
Cantidad de vistas: 70526
Comentarios sobre el artículo: 0
Células galvánicas: dispositivo, principio de funcionamiento, tipos y características principales.
Requisitos previos para la aparición de células galvánicas. Un poco de historia En 1786, el profesor de medicina italiano, fisiólogo Luigi Aloisio Galvani descubrió un fenómeno interesante: los músculos de las patas traseras de un cadáver recién abierto de una rana suspendida en ganchos de cobre se contrajeron cuando el científico los tocó con un bisturí de acero. Galvani inmediatamente concluyó que esto era una manifestación de "electricidad animal".
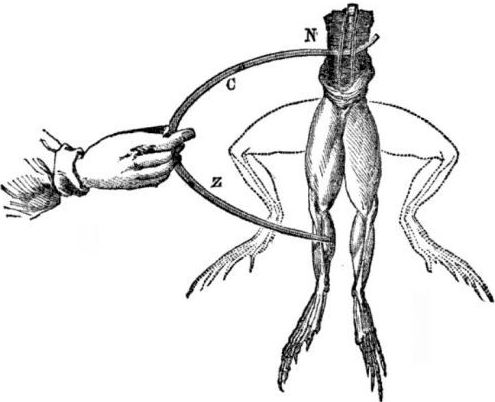
Después de la muerte de Galvani, su contemporáneo Alessandro Volta, como químico y físico, describirá y demostrará públicamente un mecanismo más realista para la aparición de corriente eléctrica cuando diferentes metales entran en contacto.
Volta, después de una serie de experimentos, llegará a la conclusión inequívoca de que la corriente aparece en el circuito debido a la presencia en él de dos conductores de metales diferentes colocados en un líquido, y esto no es en absoluto "electricidad animal", como pensó Galvani. La contracción de las patas de la rana fue consecuencia de la acción de la corriente que surge del contacto de varios metales (ganchos de cobre y un bisturí de acero).
Volta mostrará los mismos fenómenos que Galvani mostró en una rana muerta, pero en un electrómetro casero completamente inanimado, y en 1800 dará una explicación precisa de la corriente: "el conductor de segunda clase (líquido) está en el medio y está en contacto con dos conductores de primera clase de dos diferentes metales ... Como resultado de esto, surge una corriente eléctrica de una dirección u otra ".

En uno de los primeros experimentos, Volta bajó dos placas, zinc y cobre, en un frasco de ácido y las conectó con un cable. Después de eso, la placa de zinc comenzó a disolverse y se formaron burbujas de gas en el acero al cobre. Volta sugirió y probó que la corriente eléctrica fluye a través del cable.
Así se inventó el "elemento Volta", la primera celda galvánica. Por conveniencia, Volta le dio la forma de un cilindro vertical (pilar), que consta de anillos interconectados de zinc, cobre y tela impregnada de ácido. Un poste de voltaje de medio metro de alto creó un voltaje sensible a los humanos.
Desde el comienzo de la investigación fue establecida por Luigi Galvani, el nombre fuente de corriente química preservó el recuerdo de él en su nombre.
Célula galvánica Es una fuente química de corriente eléctrica, basada en la interacción de dos metales y / o sus óxidos en un electrolito, lo que lleva a la aparición de una corriente eléctrica en un circuito cerrado. Por lo tanto, en las células galvánicas, la energía química se convierte en energía eléctrica.
Células hoy

Las células de hoy se llaman baterías. Tres tipos de baterías están muy extendidas: solución salina (seca), alcalina (también se llaman alcalinas, "alcalinas" en traducción del inglés - "alcalinas") y litio. El principio de su trabajo es el mismo que describió Volta en 1800: dos metales. interactuar a través del electrolito, y surge una corriente eléctrica en un circuito cerrado externo.
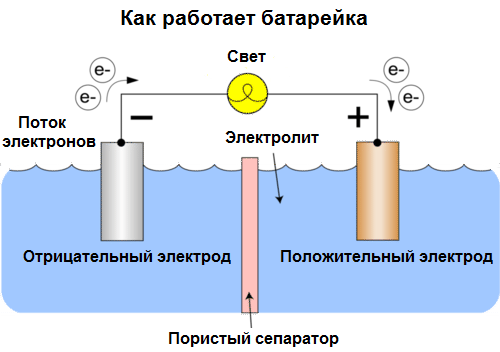
El voltaje de la batería depende de los metales utilizados y del número de celdas en la "batería". Las baterías, a diferencia de las baterías, no son capaces de restaurar sus propiedades, ya que convierten directamente la energía química, es decir, la energía de los reactivos (reductor y oxidante) que forman la batería, en energía eléctrica.
Los reactivos incluidos en la batería se consumen durante su funcionamiento, la corriente disminuye gradualmente, por lo que la acción de la fuente termina después de que los reactivos reaccionan por completo.
Los elementos alcalinos y de sal (baterías) se usan ampliamente para alimentar una variedad de dispositivos electrónicos, equipos de radio, juguetes y litio que se pueden encontrar con mayor frecuencia en dispositivos médicos portátiles como medidores de glucosa en sangre o en tecnología digital como cámaras.

Baterías de sal
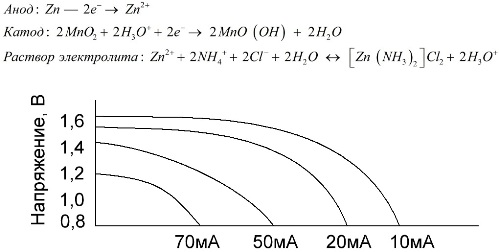
Las celdas de zinc y manganeso, que se llaman baterías de sal, son celdas galvánicas "secas", dentro de las cuales no hay una solución líquida de electrolitos.
Un electrodo de zinc (+) es un cátodo en forma de copa, y una mezcla en polvo de dióxido de manganeso y grafito sirve como ánodo. La corriente fluye a través de una barra de grafito. Como electrolito, se usa una pasta de una solución de cloruro de amonio con la adición de almidón o harina para espesar, de modo que nada fluya.
Por lo general, los fabricantes de baterías no indican la composición exacta de los elementos de sal, sin embargo, las baterías de sal son las más baratas, generalmente se usan en dispositivos donde el consumo de energía es extremadamente bajo: en horas, en controles remotos, en termómetros electrónicos, etc.

El concepto de "capacidad nominal" rara vez se utiliza para caracterizar las baterías de manganeso-zinc, ya que su capacidad depende en gran medida de las condiciones y condiciones de funcionamiento. Las principales desventajas de estos elementos son una tasa significativa de reducción de voltaje a lo largo de la descarga y una disminución significativa en la capacitancia de salida al aumentar la corriente de descarga. El voltaje de descarga final se establece dependiendo de la carga en el rango de 0.7-1.0 V.
Es importante no solo la magnitud de la corriente de descarga, sino también el horario de la carga. Con descargas intermitentes de corrientes grandes y medias, el rendimiento de las baterías aumenta notablemente en comparación con el funcionamiento continuo. Sin embargo, con pequeñas corrientes de descarga y meses de interrupciones en la operación, su capacitancia puede disminuir como resultado de la autodescarga.
El gráfico anterior muestra las curvas de descarga de una batería de sal promedio durante 4, 10, 20 y 40 horas para comparar con una alcalina, que se discutirá más adelante.
Pilas alcalinas (alcalinas)
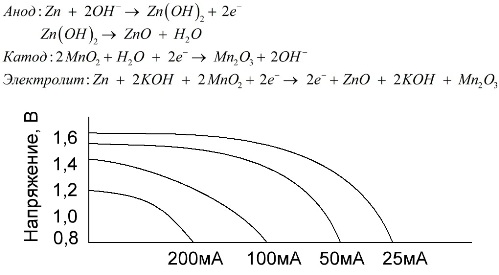
Una batería alcalina es una batería galvánica de manganeso-zinc, en la cual el dióxido de manganeso se usa como un cátodo, el zinc en polvo se usa como un ánodo, y una solución alcalina se usa como un electrolito, generalmente en forma de una pasta de hidróxido de potasio.
Estas baterías tienen una serie de ventajas (en particular, una capacidad significativamente mayor, un mejor rendimiento a bajas temperaturas y altas corrientes de carga).

Las pilas alcalinas, en comparación con la solución salina, pueden proporcionar más corriente durante mucho tiempo. Se hace posible una corriente mayor porque el zinc se usa aquí no en forma de vidrio, sino en forma de polvo que tiene un área de contacto más grande con el electrolito. El hidróxido de potasio en forma de pasta se usa como electrolito.
Gracias a la capacidad de este tipo de celdas galvánicas para suministrar una corriente significativa (hasta 1 A) durante mucho tiempo, las baterías alcalinas son más comunes en la actualidad.
En los juguetes eléctricos, en los equipos médicos portátiles, en los dispositivos electrónicos, en las cámaras, las baterías alcalinas se usan en todas partes. Sirven 1,5 veces más que la solución salina si la descarga es de baja corriente. El gráfico muestra las curvas de descarga a diferentes corrientes para compararlas con una batería de sal (el gráfico se proporcionó anteriormente) durante 4, 10, 20 y 40 horas.
Baterías de litio
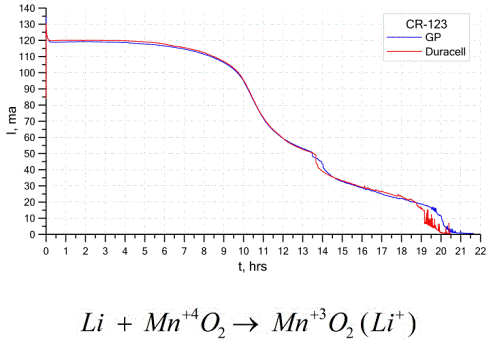
Otro tipo bastante común de celdas galvánicas son las baterías de litio, celdas galvánicas individuales no recargables en las que el litio o sus compuestos se utilizan como ánodo. Debido al uso de metales alcalinos, tienen una gran diferencia de potencial.

El cátodo y el electrolito de una celda de litio pueden ser muy diferentes, por lo que el término "celda de litio" combina un grupo de celdas con el mismo material anódico.Como cátodo, por ejemplo, se puede usar dióxido de manganeso, monofluoruro de carbono, pirita, cloruro de tionilo, etc.
Las baterías de litio se distinguen de otras baterías por su alto tiempo de ejecución y alto costo. Dependiendo del tamaño y los materiales químicos utilizados, una batería de litio puede producir voltajes de 1.5 V (compatibles con baterías alcalinas) a 3.7 V.
Estas baterías tienen la mayor capacidad por unidad de masa y una larga vida útil. Las celdas de litio se usan ampliamente en equipos electrónicos portátiles modernos: para alimentar relojes en placas base de computadoras, para alimentar dispositivos médicos portátiles, relojes, calculadoras, equipos fotográficos, etc.
El gráfico anterior muestra las curvas de descarga para dos baterías de litio de dos fabricantes populares. La corriente inicial fue de 120 mA (por resistencia del orden de 24 ohmios).
Ver también: Baterías recargables modernas: ventajas y desventajas
Ver también en bgv.electricianexp.com
: