Kategorien: Elektrikeranfänger, Industrieelektriker
Anzahl der Ansichten: 37528
Kommentare zum Artikel: 0
Die praktische Anwendung der Elektrolyse
Wenn ein elektrischer Strom durch eine Lösung oder eine Schmelze eines Elektrolyten fließt, werden gelöste Elektroden oder andere Substanzen, die Produkte von Sekundärreaktionen auf den Elektroden sind, auf den Elektroden freigesetzt. Dieser physikalisch-chemische Prozess wird Elektrolyse genannt.
Die Essenz der Elektrolyse
In dem von den Elektroden erzeugten elektrischen Feld kommen die Ionen in der leitenden Flüssigkeit in einer geordneten Bewegung. Die negative Elektrode ist die Kathode, die positive ist die Anode.
Negative Ionen, sogenannte Anionen (Ionen der Hydroxylgruppe und Säurereste), strömen zur Anode, und positive Ionen, sogenannte Kationen (Wasserstoff, Metall, Ammoniumionen usw.), strömen zur Kathode
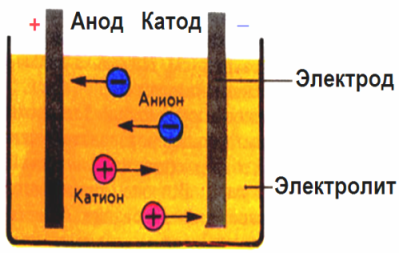
An den Elektroden findet ein Oxidations-Reduktions-Prozess statt: An der Kathode findet eine elektrochemische Reduktion von Partikeln (Atomen, Molekülen, Kationen) und an der Anode eine elektrochemische Oxidation von Partikeln (Atome, Moleküle, Anionen) statt. Dissoziationsreaktionen in einem Elektrolyten sind Primärreaktionen, und Reaktionen, die direkt an den Elektroden ablaufen, werden als Sekundärreaktionen bezeichnet.
Die Gesetze der Faradayschen Elektrolyse
Die Trennung der Elektrolysereaktionen in primäre und sekundäre half Michael Faraday, die Gesetze der Elektrolyse festzulegen:
-
Das erste Gesetz der Faradayschen Elektrolyse: Die Masse der während der Elektrolyse auf der Elektrode abgelagerten Substanz ist direkt proportional zur auf diese Elektrode übertragenen Elektrizitätsmenge. Mit der Elektrizitätsmenge ist eine elektrische Ladung gemeint, die in der Regel in Anhängern gemessen wird.
-
Das zweite Gesetz der Faradayschen Elektrolyse: Für eine gegebene Elektrizitätsmenge (elektrische Ladung) ist die Masse eines auf der Elektrode abgelagerten chemischen Elements direkt proportional zur äquivalenten Masse des Elements. Die äquivalente Masse eines Stoffes ist seine Molmasse geteilt durch eine ganze Zahl, abhängig von der chemischen Reaktion, an der der Stoff beteiligt ist.
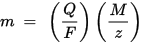
m ist die Masse der auf der Elektrode abgelagerten Substanz, Q ist die gesamte elektrische Ladung, die durch die Substanz fließt. F = 96.485,33 (83) C mol - 1 ist die Faraday-Konstante, M ist die Molmasse der Substanz (zum Beispiel die Molmasse von Wasser H2O = 18 g / mol), z ist die Valenzzahl der Ionen einer Substanz (die Anzahl der Elektronen pro Ion).
Es ist zu beachten, dass M / z die äquivalente Masse der ausgefällten Substanz ist. Für das erste Faradaysche Gesetz sind M, F und z Konstanten. Je größer der Wert von Q ist, desto größer ist der Wert von m. Für das zweite Faradaysche Gesetz sind Q, F und z Konstanten. Je größer der Wert von M / z (äquivalente Masse) ist, desto größer ist der Wert von m.
Die Elektrolyse ist heute in der Industrie und in der Technologie weit verbreitet. Beispielsweise ist die Elektrolyse eine der effektivsten Methoden zur industriellen Herstellung von Wasserstoff, Wasserstoffperoxid, Mangandioxid, Aluminium, Natrium, Magnesium, Calcium und anderen Substanzen. Die Elektrolyse wird zur Behandlung von Abwasser, beim Galvanisieren, beim Galvanisieren und schließlich bei chemischen Stromquellen eingesetzt. Aber das Wichtigste zuerst.
Gewinnung reiner Metalle aus Erzen durch Elektrolyse
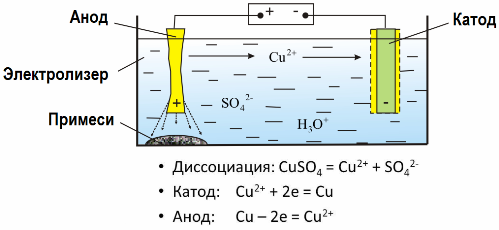
Dank der Elektrolyse werden viele Metalle aus Erzen extrahiert und einer weiteren Verarbeitung unterzogen. Wenn also Erz oder angereichertes Erz - Konzentrat - mit Reagenzien behandelt wird, gelangt das Metall in die Lösung, und dann wird das Metall durch Elektroextraktion aus der Lösung isoliert. Gleichzeitig wird an der Kathode reines Metall freigesetzt. Auf diese Weise erhalten Sie Zink, Kupfer, Cadmium.
Metalle werden einer Elektroraffinierung unterzogen, um Verunreinigungen zu entfernen und die enthaltenen Verunreinigungen in eine Form umzuwandeln, die für die weitere Verarbeitung geeignet ist. Das zu reinigende Metall wird in Form von Platten gegossen, und diese Platten werden als Anoden bei der Elektrolyse verwendet.
Wenn der Strom fließt, löst sich das Metall der Anode auf, gelangt in Form von Kationen in die Lösung, dann werden die Kationen an der Kathode entladen und bilden einen Niederschlag aus reinem Metall. Die Verunreinigungen der Anode lösen sich nicht auf - sie fallen mit der Anodenaufschlämmung aus oder gelangen in den Elektrolyten, von wo aus sie kontinuierlich oder periodisch entfernt werden.
Betrachten Sie als Beispiel Kupferelektraffinierung. Der Hauptbestandteil der Lösung - Kupfersulfat - das häufigste und billigste Salz dieses Metalls. Die Lösung hat eine geringe elektrische Leitfähigkeit. Um es zu erhöhen, wird dem Elektrolyten Schwefelsäure zugesetzt.
Zusätzlich werden kleine Mengen an Additiven in die Lösung eingeführt, um die Bildung eines kompakten Metallniederschlags zu erleichtern. Im Allgemeinen werden Kupfer, Nickel, Blei, Zinn, Silber und Gold einer elektrolytischen Raffination unterzogen.
Elektrolyse-Abwasserbehandlung
Die Elektrolyse wird in der Abwasserbehandlung eingesetzt (Verfahren der Elektrokoagulation, Elektroextraktion und Elektroflotation). Die elektrochemische Reinigungsmethode ist eine der am häufigsten verwendeten. Für die Elektrolyse werden unlösliche Anoden (Magnetit, Bleioxid, Graphit, Mangan, die auf einer Titanbasis abgeschieden werden) oder lösliche Anoden (Aluminium, Eisen) verwendet.
Mit dieser Methode werden giftige organische und anorganische Substanzen aus Wasser isoliert. Beispielsweise werden Kupferrohre mit einer Schwefelsäurelösung von Zunder gereinigt, und industrielles Abwasser muss dann durch Elektrolyse mit einer unlöslichen Anode gereinigt werden. An der Kathode wird Kupfer freigesetzt, das wiederum im selben Unternehmen verwendet werden kann.
Alkalisches Abwasser wird durch Elektrolyse aus Cyanidverbindungen gereinigt. Um die Oxidation von Cyaniden zu beschleunigen, die elektrische Leitfähigkeit zu erhöhen und Energie zu sparen, wird in Wasser ein Additiv in Form von Natriumchlorid verwendet.
Die Elektrolyse wird mit einer Graphitanode und einer Stahlkathode durchgeführt. Cyanide werden bei der elektrochemischen Oxidation zerstört und Chlor, das an der Anode freigesetzt wird. Die Wirksamkeit einer solchen Reinigung liegt nahe bei 100%.
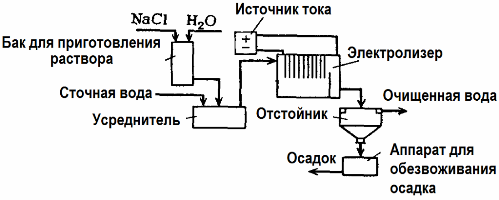
Zusätzlich zur direkten elektrochemischen Reinigung kann es in den Elektrolyseprozess einbezogen werden Koagulation. Ohne die Zugabe von Salzen wird die Elektrolyse mit löslichen Aluminium- oder Eisenanoden durchgeführt. Dann werden nicht nur die Verunreinigungen auf der Anode zerstört, sondern die Anode selbst löst sich auf. Es werden aktive dispergierte Verbindungen gebildet, die kolloidal dispergierte Verunreinigungen koagulieren (verdicken).
Diese Methode ist wirksam bei der Behandlung von Abwässern aus Fetten, Ölprodukten, Farbstoffen, Ölen, radioaktiven Substanzen usw. Sie wird als Elektrokoagulation bezeichnet.
Galvanisieren
Galvanisieren ist die elektrolytische Abscheidung bestimmter Metalle, um Produkte vor Korrosion zu schützen und ihnen ein angemessenes ästhetisches Aussehen zu verleihen (die Beschichtung erfolgt mit Chrom, Nickel, Silber, Gold, Platin usw.). Das Ding wird gründlich gereinigt, entfettet und als Kathode in einem Elektrolytbad verwendet, in das eine Salzlösung des Metalls gegossen wird, mit dem das Produkt beschichtet werden muss.
Als Anode wird eine Platte aus demselben Metall verwendet. In der Regel wird ein Paar Anodenplatten verwendet und das zu verzinkende Objekt zwischen diese gelegt.
Elektroforming
Galvanisieren - die Ablagerung von Metall auf der Oberfläche verschiedener Körper, um deren Formen zu reproduzieren: Formen zum Gießen von Teilen, Skulpturen, gedruckten Klischees usw.

Eine galvanische Abscheidung von Metall auf der Oberfläche eines Objekts ist nur möglich, wenn diese Oberfläche oder das gesamte Objekt ein elektrischer Stromleiter ist. Daher ist es ratsam, Metalle zur Herstellung von Modellen oder Formen zu verwenden. Für diesen Zweck sind schmelzbare Metalle am besten geeignet: Blei, Zinn, Lote, Holzlegierung.
Diese Metalle sind weich, leicht mit Metallwerkzeugen zu verarbeiten, gut graviert und gegossen. Nach dem Aufbau der galvanischen Schicht und der Endbearbeitung wird das Formmetall aus dem fertigen Produkt geschmolzen.
Die größten Möglichkeiten zur Herstellung von Modellen bieten jedoch nach wie vor dielektrische Materialien. Um solche Modelle zu metallisieren, ist es notwendig, ihre elektrische Oberflächenleitfähigkeit anzugeben. Erfolg oder Misserfolg hängen letztendlich hauptsächlich von der Qualität der leitenden Schicht ab. Diese Ebene kann auf drei Arten angewendet werden.
Der häufigste Weg ist GraphitisierungEs eignet sich für Modelle aus Plastilin und anderen Materialien, die das Schleifen von Graphit auf der Oberfläche ermöglichen.
Der nächste Trick ist BronzierenDas Verfahren eignet sich für Modelle mit relativ komplexer Form, für verschiedene Materialien ist jedoch aufgrund der Dicke der Bronzeschicht die Übertragung kleiner Teile etwas verzerrt.
Und endlich, Versilberungin allen Fällen geeignet, aber besonders unverzichtbar für zerbrechliche Modelle mit einer sehr komplexen Form - Pflanzen, Insekten usw.
Chemische Stromquellen
Auch die Elektrolyse ist der Hauptprozess, aufgrund dessen die fortschrittlichsten chemischen Stromquellen wie Batterien und Akkumulatoren funktionieren. Es gibt zwei Elektroden, die mit dem Elektrolyten in Kontakt stehen.
Zwischen den Elektroden wird eine Potentialdifferenz hergestellt - eine elektromotorische Kraft, die der freien Energie der Redoxreaktion entspricht. Weitere Details finden Sie hier: Chemische Stromquellen
Zitronenbatterie (zum Vergrößern auf das Bild klicken)
Die Wirkung chemischer Stromquellen basiert auf dem Auftreten räumlich getrennter Prozesse mit einem geschlossenen externen Kreislauf: Auf der negativen Anode wird das Reduktionsmittel oxidiert, die gebildeten freien Elektronen gelangen durch den externen Kreislauf zur positiven Kathode und erzeugen einen Entladestrom, wo sie an der Oxidationsreduktionsreaktion teilnehmen. Somit fließt der Fluss negativ geladener Elektronen entlang des externen Stromkreises von der Anode zur Kathode, dh von der negativen Elektrode zur positiven.
Siehe auch auf i.electricianexp.com
: